Cho 26,45 g hỗn hợp NaX và NaY ( X,Y là w halogen ở 2 chu kỳ liên tiếp ) vào dung dịch AgNO3 dư , thu được 51,95g hỗn hợp kết tủa a, tìm công thức của NaX và NaY b, tìm số mol mỗi muối trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A.
Hỗn hợp (NaX, NaY) = NaM
NaM + AgNO3 → AgM↓+NaNO3
Ta có
![]() => M = 81,6 => X,Y lần lượt là Br (80) và I (127)
=> M = 81,6 => X,Y lần lượt là Br (80) và I (127)

TH1: NaF và NaCl
Kết tủa chỉ có AgCl
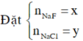
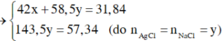
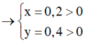
Vậy CT 2 muối có thể là NaF và NaCl
TH2: Hỗn hợp muối không chứa NaF
Đặt CT chung của 2 muối ban đầu là NaX
![]()
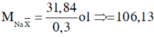
=> 2 muối là NaBr và NaI
Đáp án A

Cái chỗ M đó suy ra là \(M_X< 83,13< M_Y\)
Thì có 2 chất liên tiếp là Br (80) và I (127)

Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓+NaNO3
0,03 →0,03 (mol)
![]()
=> M = 50,3 => X,Y lần lượt là Cl và Br

Chọn A
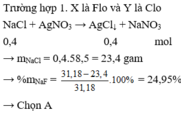
Chú ý: Với đề trắc nghiệm chọn được đáp án A có thể không cần xét thêm trường hợp 2.
Trường hợp 2. X khác Flo. Gọi hỗn hợp (NaX, NaY) tương đương với NaM



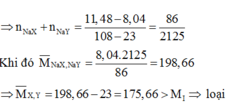

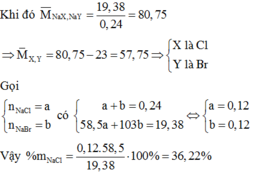
a)
Giả sử cả 2 chất đều cho kết tủa
\(NaM+AgNO_3\rightarrow AgM+NaNO_3\)
\(n_{NaM}=n_{AgM}\)
\(\Leftrightarrow\frac{26,45}{23+M}=\frac{51,95}{108+M}\)
\(\Rightarrow M=65,167\left(\frac{g}{mol}\right)\)
\(\Rightarrow\left\{{}\begin{matrix}NaX:NaCl\\NaY:NaBr\end{matrix}\right.\)
b, Gọi số mol của NaCl là a, số mol của NaBr là b
\(\left\{{}\begin{matrix}58,5a+103b=26,45\\143,5a+188b=51,95\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)