1.1. Hoàn thành các phương trình hóa học sau :
A. P2O5 + … → H3PO4
b. C2H6O + O2 → CO2 + H2O
C. CaCO3 → … + …
D. … + … → K2O
E. … + H2O → Ba(OH)2
f. KClO3 → … + …
1.2. Trong các phản ứng của 1.1, hãy cho biết :
A. Phản ứng nào có xảy ra sự oxi hóa.
B. Phản ứng nào là phản ứng hóa hợp.
C. Phản ứng nào là phản ứng phân hủy.
Câu 2 : (2,0 điểm) Cho các chất : CO2, Fe2O3, SO3, MgO. Hãy chỉ ra chất nào là oxit axit, chất nào là oxit bazơ và đọc tên các oxit đó.
Câu 3: (1,5 điểm) Một học sinh làm thí nghiệm sau : Đốt muôi sắt chứa photpho trong không khí rồi đưa nhanh muôi sắt vào bình khí oxi. Nêu hiện tượng xảy ra trong thí nghiệm sau, giải thích hiện tượng và viết phương trình hóa học .
Câu 4 : ( 1,0 điểm)
Vì sao quạt mạnh không khí vào bếp than đỏ thì lửa bùng cháy lên.
Câu 5 : (2,5 điểm)
Đốt cháy hoàn toàn 8,96 lít propan C3H8 bằng oxi trong không khí.
A. Viết phương trình hóa học.
B. Tính thể tích không khí cần dùng. Biết khí oxi chiếm 20% thể tích không khí. Khí đo ở đktc
C. Để có lượng oxi trên, cần phải phân hủy tối thiểu bao nhiêu gam KMnO4 ?
(Cho : O = 16; K = 39; Mn = 55; C = 12; H = 1)



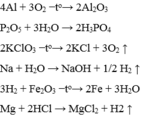
Câu 1 :
1.1
a,\(3H_2O+P_2O_5\rightarrow2H_3PO_4\)
b,\(C_2H_6O_2+3O_2\rightarrow2CO_2+3H_2O\)
c,\(CaCO_3\rightarrow CaO+CO_2\)
d,\(K_2CO_3\rightarrow K_2O+CO_2\)
e,\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
f,\(2KClO_3\rightarrow2KCl+3O_2\)
1.2
A. Phản ứng nào có xảy ra sự oxi hóa. :b
B. Phản ứng nào là phản ứng hóa hợp.:a,e
C. Phản ứng nào là phản ứng phân hủy.:c,d,f
Câu 2 :
Oxit axit là:
CO2:Cacbon điôxít
SO3:Lưu huỳnh trioxit
MgO: Magie oxit
Oxit bazo:
Fe2O3:Sắt (III) oxit
Câu 3:
Hiện tượng:cháy sáng chói tạo khói màu trắng quanh thành bình
Giải thích: P tác dụng với O2 tạo khói trắng P2O5
PTHH :\(4P+5O_2\rightarrow2P_2O_5\)
Câu 4
Vì khi quạt mạnh thì ta sẽ cung cấp O2( trong không khí) cho bếp than nên bếp than sẽ bùng cháy
Câu 5:
\(C_3H_8+5O_2\rightarrow3CO_2+4H_2O\)
Ta có :
\(V_{O2}=5V_{C3H8}=8,96.5=44,8\left(l\right)\)
\(V_{kk}=44,8.5=224\left(l\right)\)
\(n_{O2}=\frac{44,8}{22,4}=2\left(mol\right)\)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO4}=2n_{O2}=2.2=4\left(mol\right)\)
\(\Rightarrow m_{KMnO4}=4.\left(39+55+16.4\right)=632\left(g\right)\)