Đốt cháy hoàn toàn 4,48l H2 trong 3,36l O2.Ngưng tụ sản phẩm thu được chất lỏng A và khí B.Cho toàn bộ khí B phản ứng hết với 5,6g Fe thu được hỗn hợp chất rắn C.Hòa tan toàn bộ chất rắn C =100g dung dịch HCl 14,6% thu được dung dịch D và khí E a) Xác định các chất có trong A, B, C, D, E. b) Tính thể tích khí E. c) Tính nồng độ % của các chất có trong D(Các khí đo ở được)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
A: H2O
B: O2
C: Al, Al2O3
D: AlCl3, HCl
E: H2
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\); \(n_{O_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,2-->0,1------->0,2
=> mH2O(A) = 0,2.18 = 3,6 (g)
\(n_{O_2\left(dư\right)}=0,16-0,1=0,06\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,08<-0,06------>0,04
=> \(\left\{{}\begin{matrix}m_{Al_2O_3\left(C\right)}=0,04.102=4,08\left(g\right)\\m_{Al\left(C\right)}=2,7-0,08.27=0,54\left(g\right)\end{matrix}\right.\)
b)
nHCl = 0,1.4 = 0,4 (mol)
\(n_{Al\left(C\right)}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,02->0,06---->0,02-->0,03
Al2O3 + 6HCl --> 2AlCl3 + 3H2O
0,04-->0,24---->0,08
=> \(D\left\{{}\begin{matrix}AlCl_3:0,02+0,08=0,1\left(mol\right)\\HCl\left(dư\right):0,4-0,06-0,24=0,1\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(AlCl_3\right)}=\dfrac{0,1}{0,1}=1M\\C_{M\left(HCl.dư\right)}=\dfrac{0,1}{0,1}=1M\end{matrix}\right.\)
c) VO2(B) = 0,06.22,4 = 1,344 (l)
VH2(E) = 0,03.22,4 = 0,672 (l)

Nhận thấy sau khi qua HNO3 thì tất cả Fe đều chuyển về Fe3+ . Như vậy trạngthái đầu là Fe, trạng thái cuối là Fe3+
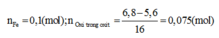
Các quá trình nhường và nhận electron:
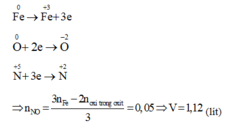

Phương trình phản ứng đốt cháy H2 trong ôxi:
Vậy ngưng tụ sản phẩm: chất lỏng A là H2O có khối lượng: 0,2.18 = 3,6 (g);Khí B là oxi
khi cho B phản ứng với Fe: (2)[/FONT]
Từ kết quả trên: O2 tham gia phản ứng (2) là 0,05mol.Nên Fe cần cho phản ứng (2) là: 0,075mol. => Chất rắn C gồm: 0,025 mol Fe3O4 và (0,1 - 0,075) = 0,025mol Fe dư và có khối lượng: 0,025. 232 + 0,025. 56 = 7,2 (g)+ Cho toàn bộ chất rắn C vào dd HCl :

Áp dụng định luật bảo toàn khối lượng
mkhí A = mO2 = 98 - 93,2 = 4.8 (g)
⇔ nO2 = 0.15 (mol)
X + A ⇔ \(X\left\{{}\begin{matrix}Fe:a\\Mg:b\end{matrix}\right.\)(mol) + 0,15 mol O2 \(\underrightarrow{100\%}\) 15,6g chất rắn
⇔ mX = 56a + 24b = 15,6 - 0,15 . 32 = 10.8
15,6g Y \(\left\{{}\begin{matrix}Mg,Fe\\oxit\end{matrix}\right.\) ⇔ 15,6g \(\left\{{}\begin{matrix}Mg:a\\Fe:b\\O:0.3\end{matrix}\right.\) (mol)
Quá trình oxi hóa ________________ Quá trình khử
Mgo → Mg+2 + 2e O0 + 2e ⇒ O-2
a .................... 2a 0,3 ...... 0,6
Fe0 → Fe+3 + 3e S+6 + 2e → S+4
b ................... 3b 0.05 ← 0.025
Vậy 2a + 3b = 0,65
Giải ra a,b

Gọi $n_{Al}= a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 4,44(1)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
B gồm : $Al_2O_3, Fe$
$n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,5a(mol)$
Suy ra: $0,5a.102 + 56b = 5,4(2)$
Từ (1)(2) suy ra a = 0,04 ; b = 0,06
$m_{Al} = 0,04.27 =1,08\ gam$
$m_{Fe} = 0,06.56 = 3,36\ gam$

Chọn đáp án D
![]() = 0,03 mol
= 0,03 mol
⇒![]() mol;
mol; ![]() 0,06 mol.
0,06 mol.
![]()
⇒ ![]() mol.
mol.
⇒ số C : số H : số O
= 0,03 : 0,06 : 0,02 = 3 : 6 : 2
→ X: (C3H6O2)n.
⇒ MX = 74n = 18,5 × 4
⇒ n = 1
⇒ X là C3H6O2.
X tác dụng được với NaOH
⇒ X là este hoặc axit.
![]() mol
mol
⇒![]() gam.
gam.
![]() mol
mol
![]()
X là HCOOC2H5.
Bảo toàn khối lượng:
![]()
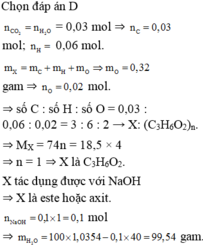
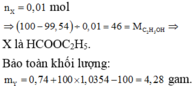
còn lại bạn tự làm nha