Câu 17: Thể tích dung dịch NaOH 1M để tác dụng hoàn toàn với 2,24 lít khí clo (đktc) ở điều kiện
thường là
A. 50 ml. B. 200 ml. C. 100 ml. D. 150 ml.
Câu 18: Người ta cần dùng 7,84 lít khí CO (đktc) để khử hoàn toàn 20 gam hỗn hợp CuO và Fe2O3 ở nhiệt độ cao. Thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp trước phản ứng là:
A. 20% CuO và 80% Fe2O3. B. 40% CuO và 60% Fe2O3.
C. 80% CuO và 20% Fe2O3. D. 60% CuO và 40% Fe2O3.
Câu 19: Cho 2,24 lít H2 tác dụng với 0,672 lít khí Cl2 rồi hòa tan sản phẩm vào 19,27 gam nước được dung dịch A. Biết các thể tích khí đo ở đktc. Nồng độ phần trăm của chất tan trong dung dịch A là
A. 10,21%. B. 5,38%. C. 12,21%. D. 11,36%.
Câu 20: Nung hỗn hợp 8,4 gam sắt và 3,2 gam lưu huỳnh trong môi trường không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 3M phản ứng vừa đủ với A thu được hỗn hợp khí B. Thể tích dung dịch HCl 3M đã tham gia phản ứng là
A. 200 ml. B. 300 ml. C. 150 ml. D. 100 ml.
Câu 21: Cho 2,24 lít khí CO2 (đktc) tác dụng với 200 ml dung dịch NaOH 2M. Khối lượng muối có trong dung dịch sau phản ứng là
A. 10,6 gam. B. 21,2 gam. C. 8,4 gam. D. 10 gam.
Câu 22: Trộn 200 gam dung dịch NaOH 10% với 150 gam dung dịch HCl 7,3% thu được dung dịch X. Trong X chứa chất tan Y, chất Y làm đổi màu quỳ tím (ẩm). Nồng độ phần trăm của Y trong dung dịch X là
A. 2,29%. B. 0,730%. C. 2,19%. D. 1,46%
Câu 23: Cho 448 ml khí CO2 tác dụng với 20 gam dung dịch NaOH 6% thu được dung dịch A. Nồng độ phần trăm của muối trung hòa trong dung dịch A là
A. 6,12%. B. 5,08%. C. 10,20%. D. 4,02%.
Câu 24: Cho 2 kim loại Fe và Cu tác dụng với khí clo dư thu được 59,5 gam hỗn hợp muối. Cũng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam muối. Phần trăm theo khối lượng của Cu trong hỗn hợp là
A. 69,57%. B. 30,43%. C. 53,33%. D. 46,67%
Câu 25: Cho hỗn hợp khí A gồm CO và CO2 đi vào dung dịch Ca(OH)2 dư, thu được 1 gam chất kết tủa màu trắng. Nếu cho hỗn hợp khí này đi qua CuO dư thì thu được 0,64 gam kim loại màu đỏ. Thành phần phần trăm theo thể tích của CO trong hỗn hợp là
A. 50%. B. 40%. C. 55%. D. 60%.
Câu 26: Cho 6,72 lít khí clo (đktc) tác dụng với H2 dư. Hấp thụ toàn bộ sản phẩm vào nước thu được 200 ml dung dịch A. Nồng độ mol của dung dịch A là
A. 1,5M. B. 0,3M. C. 0,15M. D. 3M.
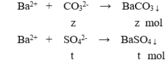
Câu 27: Cho 34 gam hỗn hợp bột CaCO3 và CaSO4 tác dụng hết với lượng dư dung dịch HCl thấy thoát ra 2,24 lít khí (đktc). Phần trăm theo khối lượng của muối sunfat trong hỗn hợp là
A. 35,29%. B. 29,41%. C. 70,59%. D. 75,09%.
Câu 28: Cho 16,8 gam kim loại A phản ứng hết với khí clo dư tạo thành 48,75 gam muối. Kim loại A là
A. Mg. B. Ag. C. Cu. D. Fe.
Câu 29: Cho 10 lít (ở đktc) hỗn hợp khí A gồm N2, CO và CO2 đi qua một lượng dư nước vôi trong, rồi qua đồng(II) oxit dư đốt nóng thì thu được 5 gam kết tủa và 3,2 gam đồng. Phần trăm theo thể tích của khí N2 trong hỗn hợp A là
A. 77,6%. B. 76,6%. C. 60%. D. 61%.
Câu 30: Cho 10 gam dung dịch muối sắt clorua 12,7% tác dụng với dung dịch bạc nitrat dư thì thu được 2,87 gam kết tủa. Công thức hóa học của muối sắt đã dùng là
A. FeCl2. B. FeCl. C. FeCl3. D. Fe3Cl.
Câu 31: Nung nóng 50,6 gam hỗn hợp A gồm CaCO3 và Na2CO3 đến phản ứng hoàn toàn. Toàn bộ khí CO2 thu được dẫn vào nước vôi trong dư thu được 40 gam kết tủa. Phần trăm theo khối lượng Na2CO3 trong A là A. 40,95% . B. 20,95%. C. 79,05%. D. 59,05%.

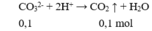
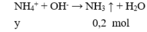
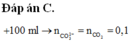
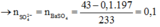
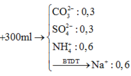
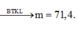
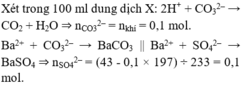
17B 18. 68%CuO, 32% Fe2O3 19A 20D 21A 22A 23B 24C 25A 26D 27C 28D 29(không hiểu đề bài lắm T.T sorry nha) 30A 31C