cho 2,2 g hỗn hợp hai muối nax tác dụng vừa đủ với 150 ml dung dịch AgNO3 thu được m gam hỗn hợp kết tủa. xác định m và tên hai halogen kế tiếp
Giúp hộ!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓+NaNO3
0,03 →0,03 (mol)
![]()
=> M = 50,3 => X,Y lần lượt là Cl và Br

Đáp án D
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
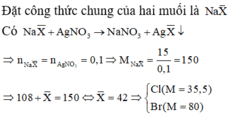
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
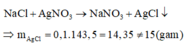
Do đó trường hợp này không thỏa mãn.

Đặt công thức trung bình của 2 muối trên là NaR
Ta có \(n_{NaR}=\frac{16,15}{23+R}=x\left(mol\right)\)
\(n_{AgR}=\frac{33,15}{108+R}\)
NaR+ AgNO3→ AgR+ NaNO3
x_____x_______x________x____(mol)
\(n_{AgR}=\frac{33,15}{108+R}=x=\frac{16,15}{23+R}=n_{NaR}\)
\(\rightarrow\)R=57,75\(\rightarrow\) X<57,75<Y
\(\rightarrow\)X là Cl , Y là Br

NaX + AgNO 3 → NaNO 3 + AgX
a mol a mol a mol a mol
NaY + AgNO 3 → NaNO 3 + AgY
b mol b moi b mol b mol
n AgNO 3 = 0,2 x 150/1000 = 0,O3 mol
m AgNO 3 = 0,3 x 170 = 5,1g
n NaNO 3 = 0,O3 => m NaNO 3 = 0,03 x 85 = 2,55g
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + m kết tủa → m kết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,O3 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
X > 1,51/0,03 > Y > X > 50,3 > Y
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).

Quy NaX và NaY về NaR
\(n_{AgNO_3}=0,15.0,2=0,05\left(mol\right)\)
PTHH: \(AgNO_3+NaR\rightarrow AgR\downarrow+NaNO_3\)
0,05------>0,05
\(\rightarrow M_R=\dfrac{2,2}{0,05}=44\left(g\text{/}mol\right)\)
Mà X và Y là 2 nguyên tố halogen thuộc 2 chu kì liên tiếp
\(\rightarrow M_X< M_R< M_Y\rightarrow M_X< 44< M_Y\)
---> X và Y là Cl và Br

Chọn A
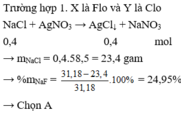
Chú ý: Với đề trắc nghiệm chọn được đáp án A có thể không cần xét thêm trường hợp 2.
Trường hợp 2. X khác Flo. Gọi hỗn hợp (NaX, NaY) tương đương với NaM

Ta có :
\(n_{H2}=0,1\left(mol\right)\)
\(n_{HCl}=n_{Cl^-}=2n_{H2}=2.0,1=0,2\left(mol\right)\)
\(\rightarrow m_{Muoi}=m_{KL}+m_{Cl^-}=4,2+0,2.35,5=11,3\left(g\right)\)