Có một loại oleum X trong đó SO3 chiếm 71% theo khối lượng. Lấy a gam X hòa tan hoàn toàn vào b gam dung dịch H2SO4 c % được dung dịch Y có nồng đọ d%. Lập biểu thức tính d theo a, b và c.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

Đáp án : C
Xét 100g Oleum có 70g SO3 và 30g H2SO4
Khi hòa tn vào nước thu được dung dịch có H2SO4 chiếm 80%
=> SO3 chiếm 20%
n S = n H 2 S O 4 + n S O 3 = 1,18 mol
Dung dịch sau :
⇒ n H 2 S O 4 = 0 , 9 m o l
=> n H 2 S O 4 m ớ i = n H 2 S O 4 s a u - n H 2 S O 4 đ ầ u = 0 , 6 m o l = n H 2 O
=> m H 2 O = 10,8g

Gọi oleum X : H2SO4.nSO3
SO3 chiếm 71% theo khối lượng
\(\Rightarrow\) %SO3 = 80n/80n+98 = 71/100 = 0,71
\(\Leftrightarrow\) 80n = 0,71(80n+98)
\(\Leftrightarrow\) 23,2n = 69,58 \(\Leftrightarrow\) n = 3
Vậy công thức oleum là H2SO4.3SO3
_ Lấy 8,45 g X vào 20 g dd H2SO4 10%
\(\Rightarrow\) n X = 8,45/338 = 0,025 = n H2SO4 ( trong X )
\(\Rightarrow\) m H2SO4 = 0,025 . 98 = 2,45 g
\(\Rightarrow\) n SO3 = \(\dfrac{3.8,45}{338}\)= 0,075 mol
m ct(H2SO4 10%) = \(\dfrac{20.10}{100}\) = 2 g
_ SO3 trong X sẽ tác dụng với dd H2SO4 :
SO3 + H2O \(\rightarrow\) H2SO4
0,075..............0,075 (mol)
\(\Rightarrow\) m H2SO4(từ SO3) = 0,075 . 98 = 7,35 g
\(\Rightarrow\) m H2SO4(tạo thành) = 2 + 7,35 + 2,45 = 11,8 g
_ m dd sau pứ = 8,45 + 20 = 28,45 g
C% dd Y = \(\dfrac{11,8}{28,45}\).100% = 41,5%

PTHH: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Ta có: \(n_{CaO}=\dfrac{2,24}{56}=0,04\left(mol\right)=n_{Ca\left(OH\right)_2}\)
\(\Rightarrow m_{Ca\left(OH\right)_2}=0,04\cdot74=2,96\left(g\right)\)
Mặt khác: \(m_{dd}=m_{CaO}+m_{H_2O}=90\left(g\right)\)
\(\Rightarrow C\%_{Ca\left(OH\right)_2}=\dfrac{2,96}{90}\cdot100\%\approx3,3\%\)
Hòa tan hoàn toàn 2,24 gam CaO vào cốc thủy tinh chứa 87,76gam H2O dư, thu được dung dịch X
a) Viết PTHH
CaO + H2O -------> Ca(OH)2
b) Dung dịch X chứa những chất gì? Tính khối lượng từng chất có trong dung dịch X?
Dung dịch X gồm Ca(OH)2, H2O dư
\(n_{CaO}=n_{H_2O\left(pứ\right)}=n_{Ca\left(OH\right)_2}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
\(\Rightarrow m_{H_2O\left(dư\right)}=87,76-0,04.18=87,04\left(g\right)\)
\(m_{Ca\left(OH\right)_2}=0,04.74=2,96\left(g\right)\)
c) Tính khối lượng dung dịch X theo 2 cách
Cách 1: Bảo toàn khối lượng => \(m_{ddX}=2,24+87,76=90\left(g\right)\)
Cách 2: \(m_{ddX}=m_{Ca\left(OH\right)_2}+m_{H_2Odư}=2,96+87,04=90\left(g\right)\)
d) Tính nồng độ % của dung dịch X
\(C\%_{Ca\left(OH\right)_2}=\dfrac{2,96}{90}.100=3,29\%\)

Đáp án A
+ Từ giả thiết suy ra X chứa MgSO 4 , FeSO 4 , Fe 2 ( SO 4 ) 3 Al 2 ( SO 4 ) 3 , ZnSO 4 , K 2 SO 4 + n KNO 3 = x ; n H 2 SO 4 = 2 x ⇒ m muối / X = 8 , 6 + 39 x + 2 x . 96 = 43 , 25 ⇒ x = 0 , 15 . + n H 2 = y ⇒ m Y = 50 y , n H 2 O = 0 , 3 - y . + BTKL : m kim loại + m ( KNO 3 , H 2 SO 4 ) = m muối + m Y + m H 2 O BTKL : m kim loại + m dd ( KNO 3 , H 2 SO 4 ) = m dd X + m Y ⇒ 8 , 6 + 0 , 15 . 101 + 0 , 3 . 98 = 43 , 25 + 50 y + 18 ( 0 , 3 - y ) 8 , 6 + 100 = m dd X + 50 y ⇒ y = 0 , 140625 m dd X = 101 , 56875 + KOH + X → dd chỉ chứa K 2 SO 4 + Z ↓ ⇒ n KOH = 2 n K 2 SO 4 - n KNO 3 = 0 , 45 n OH - trong Z = n KOH = 0 , 45 + Khi nung Z sẽ xảy ra quá trình : 0 , 45 mol OH - → 0 , 225 mol O 2 - O 2 → oxi hóa Fe 2 + z mol O 2 - ⇒ 0 , 225 . 16 + 16 z = 12 , 6 - 8 , 6 ⇒ z = 0 , 025 ⇒ BTE : n Fe 2 + = 2 n O 2 - = 0 , 05 ⇒ C % FeSO 4 = 152 . 0 , 05 101 , 56875 . 100 % = 7 , 48 % gần nhất với 7 , 5 %
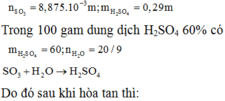
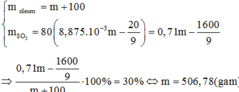


Oleum H2SO4.nSO3 có 0,71a gam SO3 và 0,29a gam H2SO4
Sau khi thả oleum vào dd H2SO4, SO3 tan hết tạo H2SO4
\(n_{SO3}=\frac{71a}{8000}=n_{H2SO4}\)
\(\rightarrow m_{H2SO4}=0,86975a\left(g\right)\)
Trong b gam dd H2SO4 C% có 0,01bc gam H2SO4
Tổng \(m_{H2SO4}=0,86975a+0,01bc\) gam H2SO4
\(m_{dd_Y}=a+b\left(g\right)\)
\(\rightarrow d=\frac{100\left(0,86975a+0,01bc\right)}{a+b}\)
\(=\frac{86,975a+bc}{a+b}\)