Trộn 20ml dd KCl 0,05Mvới 20ml dd H2SO4 0,075M. Nếu coi thể tích sau khi pha trộn bằng thể tích của hai dung dịch đầu thì pH của dung dịch thu được là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
nH+ = 0,003; Vdd trộn = 20 + 20 = 40ml ⇒ [H+] = 0,075 ⇒ pH = -log10[H+] ≈ 1,12.

\(n_{H^+}=2.0,2.0,03=0,012\left(mol\right)\)
\(n_{OH^-}=0,8.0,02=0,016\left(mol\right)\)
\(n_{OH^-dư}=0,004\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,004}{0,03+0,02}=0,08M\)
\(\Rightarrow\left[H^+\right]=1,25.10^{-13}\)
\(\Rightarrow pH=-log\left[H^+\right]\approx12,9\)

Chọn A.
Ta có: n H C l =0,001 mol, n H 2 S O 4 =0,0015 mol
Tổng số mol H+ = 0,004 mol ⇒ [H+] = 0,004 : 0,04 = 0,1 = 10-1 M ⇒ pH = 1.

Các pthh xảy ra:
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(NaOH+HNO_3\rightarrow NaNO_3+H_2O\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
Cho B tác dụng với \(BaCl_2dư\) chỉ có \(H_2SO_4\) phản ứng.
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)

Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2
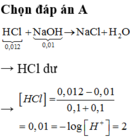
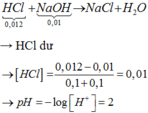
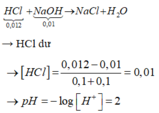
Thể tích dd sau khi trộn là 20+20=40ml=0,04l
nH2SO4=0,0015mol\(\rightarrow\)nH+=0,003mol
\(\rightarrow\)CMH+=\(\frac{0,003}{0,04}\)=0,075M
\(\rightarrow\)pH=-log0,075=1,12