Đốt cháy hh goomf 0,02mol Mg và 0,03 mol Fe với hh khí X gồm Clo và Oxi , sau phản ứng chỉ thu được 4,77gam hh Y gồm các oxit và muối clorua (không còn khí dư) . Hoà tan Y bằng dd Ag NO3 loãng dư thu được 9,69 gam kết tủa . Phần trăm thể tích của oxi trong hh X là bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : B
Bảo toàn khối lượng
⇒ m C l 2 + m O 2 = 2 , 61
Cl2 : x mol ; O2 : y mol ; Ag:z mol ; AgCl : (2x + 0,03)
ta có 71x + 32y = 2,61
(2x + 0,03).143,5 + 108z =13,995
2x+ 4y + z= 0,02.2 + 0,03.3
=>x = 0,03 ; y = 0,015 ; z = 0,01
=>%VO2 = 0,015.100/(0,015 + 0,03) = 33,33%

Đáp án : D
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%

Chọn C
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%

Đáp án : B
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích :
2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O
=> nO = 1 2 nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
Sau đó phản ứng với AgNO3 tạo :
(2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> % V C l 2 X = 53,85%

Đáp án C
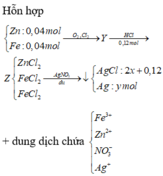
Khi tác dụng với HCl chỉ có các oxit bị hòa tan
→ nHCl = 4nO2 → nO2 = 0,03 mol
Gọi số mol của Cl2 và Ag lần lượt là x, y mol
Bảo toàn nguyên tố Cl → nAgCl = 2nCL2 + nHCl = 2. x + 0,12
→ 143,5( 2. x + 0,12) + 108y = 28,345
Bảo toàn electron cho toàn bộ quá trình 3nFe + 2nZn = 2nCl2 + 4nO2 + nAg
→ 3. 0,04 + 2.0,04 = 2.x + 4. 0,03 + y
Giải hệ → x= 0,035 và y = 0,01
![]()




9,69g kết tủa là AgCl
\(\rightarrow\)n AgCl= \(\frac{9,69}{143,5}\)= 0,07(mol)
\(\rightarrow\) n Cl2 = 0,035(mol)
m Y = m Mg + m Fe + m Cl2 + m O2
4.77= 0,02.24+0,03.56+0,035.71+m O2
\(\rightarrow\)m O2 = 0,125(g)
\(\rightarrow\) n O2 = 0,004(mol)
%V O2 = \(\frac{0,004}{0,039}.100\%\)= 10,26%