Bài 1: Cho 3,36(g) một kim loại kiềm M tác dụng hoàn toàn với 100 ml nước(d=1g/ml) thì thu được 0,48(g) khí H2(đkc).
a. Tìm tên kim loại đó.
b. Tính nồng độ mol của dung dịch thu được.
Bài 2: Để hòa tan hoàn toàn 1,16(g) một hidroxit kim loại R hóa trị II cần dùng 1,46(g) HCl.
a. Xác định tên kim loại R, công thức hidroxit.
b. Tính khối lượng muối thu được.
Bài 3: Hòa tan hoàn toàn 3,68(g) một kim loại kiềm A vào 200 ml nước thì thu được dung dịch X và 1,7921 khí H2.
a. Xác định tên kim loại A.
b. Tính nồng độ mol của dung dịch X xem như thể tích thay đổi không đáng kể.

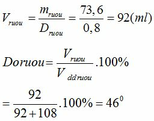

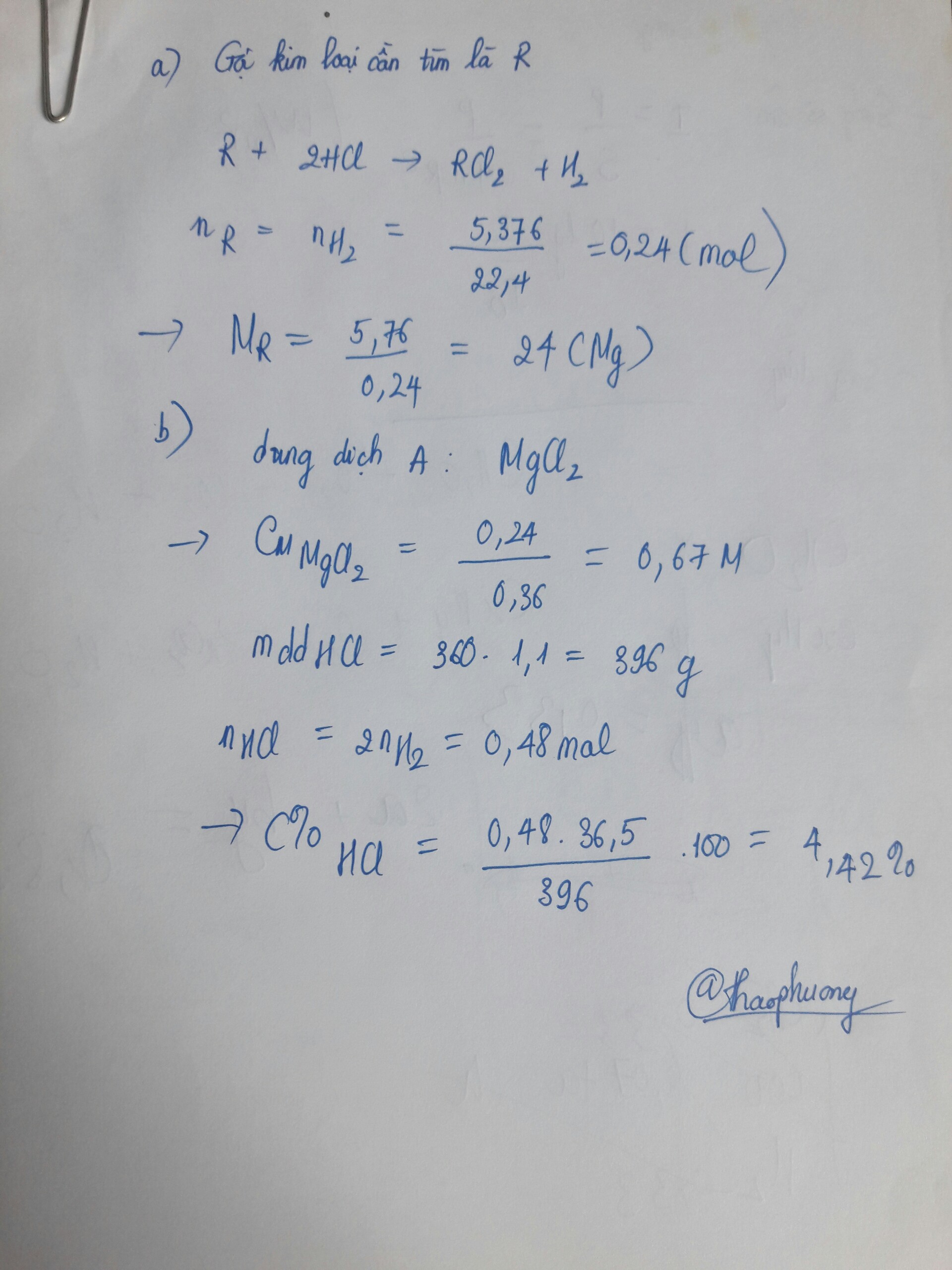
1.
a)2M+2H2O\(\rightarrow\)2MOH+H2
nH2=\(\frac{0,48}{2}\)=0,24(mol)
\(\rightarrow\)nM=0,24.2=0,48(mol)
M=\(\frac{3,36}{0,48}\)=7
\(\rightarrow\)M là Liti
b)
nLiOH=nLi=0,48(mol)
CMLiOH=\(\frac{0,48}{0,1}\)=4,8(M)
2.
Gọi công thức hidroxit là R(OH)2
a. R(OH)2+2HCl\(\rightarrow\)RCl2+2H2O
nHCl=\(\frac{1,46}{36,5}\)=0,04
\(\rightarrow\)nR(OH)2=0,5nHCL=0,02
Ta có R(OH)2=\(\frac{1,16}{0,02}\)=58\(\rightarrow\)R+17.2=58\(\rightarrow\)R=24
\(\rightarrow\)R là Mg
Công thức hidroxit là Mg(OH)2
b. nMgCl2=nMg(OH)2=0,02
\(\rightarrow\)khối lượng muối là m=0,02.95=1,9
3.
a. 2A+2H2O\(\rightarrow\)2AOH+H2
nH2=0,08
\(\rightarrow\)nA=2nH2=0,16
\(\rightarrow\)A=\(\frac{3,68}{0,16}\)=23\(\rightarrow\)A là Natri
b. nAOH=nA=0,16
\(\rightarrow\)CMNaOH=\(\frac{0,16}{0,2}\)=0,8M