Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó đem nghiền nhỏ , trộn đều rồi chia thành 2 phần :
-P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2(đktc) và phần ko tan có khối lượng = 44,8% khối lượng P1.
-P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc).
Tính m hh ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
P1 : nH2 = 0,4 mol => nAl = 0,8/3 (mol)
Vì có Al dư nên Fe2O3 chuyển hết thành Fe
Gọi số mol các chất trong phần 1 là : 2a mol Fe ; a mol Al2O3 ; b mol Al
Phần hai sẽ có thành phần các chất là : 2ak mol Fe ; ak mol Al2O3 ; bk mol Al
P1 : nAl = b = 0,8/3 (mol)
Và mFe = 44,8%.mP1 => 112a = 0,448( 112a + 102a + 27b) => 4a = 3b
P2 : nH2 = 2ak + 1,5bk = 0,12 mol
Giải hệ 3 phương trình 3 ẩn trên ta được :
,a = 0,2 mol ; k = 0,15
=> m2 = 0,15m1
=> m = 1,15m1 = 57,5g

Đáp án A
P 1 : n H 2 = 0 , 4 m o l → n A l = 0 , 8 3 m o l
Vì có Al dư nên Fe2O3 chuyển hết thành Fe
Gọi số mol các chất trong phần 1 là: 2a mol Fe; a mol Al2O3; b mol Al
Phần hai sẽ có thành phần các chất là: 2ak mol Fe; ak mol Al2O3; bk mol Al
P 1 : n A l = b = 0 , 8 3 m o l
Và m F e = 44 , 8 % . m P 1 → 112 a = 0 , 448 ( 112 a + 102 a + 27 b ) → 4 a = 3 b
P 2 : n H 2 = 2 a k + 1 , 5 b k = 0 , 12 m o l
Giải hệ 3 phương trình 3 ẩn trên ta được:
a = 0,2 mol ; k = 0,15
→ m2= 0,15m1
→ m = 1,15m1 = 57,5g


Giải hệ 3 phương trình 3 ẩn trên ta được:
a = 0,2 mol; k = 0,15
→ m2= 0,15m1
→ m = 1,15.m1 = 57,5g

Chọn A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam

Chọn A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam

Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam
Đáp án A

Đáp án A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl = nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư:
nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy: m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 = 0,12 mol => m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam


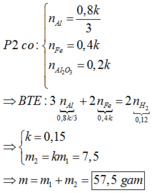
Các phản ứng xảy ra hoàn toàn
\(\text{2Al + Fe2O3 → Al2O3 + 2Fe}\)
Phần 1: Tác dụng với NaOH dư sinh ra khí H2 → Al còn dư
nH2 = \(\text{8,96 : 22,4 = 0,4 mol}\)
\(\text{Al + NaOH + H2O → NaAlO2 + 3/2H2↑}\)
4/15____________________________0,4
Trong phần 1 gồm:
Al (4/15 mol)
Al2O3 (x mol)
Fe (2x mol)
Ta có:
\(\frac{2x.56}{\frac{4}{15}.27+x.102+2x.56}.100\%=44,8\%\)
\(\frac{x}{7,2+414x}=0,004\)
\(\rightarrow x=0,2\)
m1 = \(\text{2.0,2.56 : 44,8% = 50(g)}\)
Khối lượng phần 2 gấp m lần khối lượng phần 1
Trong phần 2 gồm: Al (4m/15 mol)
Al2O3 (xm mol)
Fe (0,4m mol)
Phần 2: tác dụng với HCl
nH2 = \(\text{2,688 : 22,4 = 0,12 mol}\)
\(\text{ 2Al + 6HCl → 2AlCl3 + 3H2↑}\)
4m/15__________________0,4m
\(\text{ Fe + 2HCl → FeCl2 + H2↑}\)
0,4m_________________0,4m
\(\text{nH2 = 0,4m + 0,4m = 0,12}\)
\(\text{→ m = 0,15}\)
m2 = \(\text{50 + 7,5 = 57,5(g)}\)
Khối lượng hỗn hợp ban đầu: \(\text{50 + 7,5 = 57,5(g)}\)