A là 1 mẫu hỗn hợp gồm Zn và Cu được chia đôi . Phần 1 hòa tan bằng HCl dư thấy còn 1g không tan . Phần 2 được thêm 4g Cu được hỗn hợp dd B thì % lượng Zn trong B nhỏ hơn lượng Zn trong A là 33,33 % .Tìm lượng Cu trong A biết rằng khi ngâm B vào dd NaOH thì sau 1 thời gian VH2 thoát ra đã vượt quá 0,6 lít (đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(Zn+2HCl\rightarrow ZnCl_2H_2\)
b, Mỗi phần : \(\left\{{}\begin{matrix}Cu:x\left(g\right)\\Zn:y\left(g\right)\end{matrix}\right.\)
\(\Rightarrow x=1\) ( Cu không tan trong HCl)
\(\%_{Zn}=\frac{y.100}{y+1}\)
Phần 2: \(m_{Cu}=5\left(g\right)\)
\(\%m_{Zn}=\frac{y.100}{y+5}\Rightarrow\frac{y.100}{y+1}-\frac{y.100}{y+5}=33,33\)
\(\Leftrightarrow100y\left(y+5\right)-100y\left(y+1\right)=33,33\left(y+1\right)\left(y+5\right)\)
\(\Leftrightarrow33,33\left(y^2+6y+5\right)=400y\Rightarrow\left[{}\begin{matrix}y=1\\y=5\end{matrix}\right.\)
Vậy B \(\left[{}\begin{matrix}5\left(g\right)Cu,5\left(g\right)Zn\left(1\right)\\5\left(g\right)\left(Cu\right),1\left(g\right)Zn\left(2\right)\end{matrix}\right.\)
TH1: \(n_{Zn}=\frac{1}{13}\left(mol\right)\)
\(Zn+2NaOH\rightarrow Na_2ZnO_2+H_2\)
1/13_______________________1/13
\(\Rightarrow V_{H2}=1,723>0,6\left(TM\right)\)
TH2: \(n_{Zn}=\frac{1}{65}\left(mol\right)=n_{H2}\)
\(\Rightarrow V_{H2}=0,34\left(l\right)< 0,6\left(l\right)\left(Loai\right)\)
Vậy \(\left\{{}\begin{matrix}1\left(g\right)Cu\\5\left(g\right)Zn\end{matrix}\right.\) ( mỗi phần A)
\(\Rightarrow\%m_{Cu}=\frac{1.100}{6}=16,67\%\)
c, Xem lại đề

Giải thích: Đáp án A
P1 : 1g không tan chính là Cu. Còn lại là x g Zn
=> %mZn = 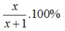
P2 : Thêm 4g Al vào => %mZn = 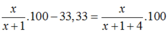
=> x = 1g => %mCu(X) = 16,67%

a)
Gọi khối lượng của Zn trong đồng thau là : a(g)
Zn+ H2SO4→ ZnSO4+ H2↑
1(g) chất rắn không tan là: Cu
Ta có PT:\(\frac{a}{a+1}.\frac{1}{3}=\frac{a}{a+1+4}\)
⇒ a= 1 (g)
%Cu (đồng thau)=11+111+1 .100%= 50%
b)
Trong B:
%Cu=\(\frac{1}{6}\) .100%= 16,67%
%Zn=\(\frac{1}{6}\).100%= 16,67%
%Al= 100%- 2. 16,67%=66,66%
⇒ Để có tỉ lệ như đề bài yêu cầu thì phải :
Tăng mCu lên: x (g)
Tăng mZn lên : y (g)
mAl giữ nguyên
Ta có :
\(\frac{x+1}{x+y+6}.100\%=20\%\)
\(\frac{y+1}{x+y+6}\text{.100%= 50%}\)
⇒ x=\(\frac{5}{3}\) (g) ; y=\(\frac{17}{3}\) (g)

HD:
Câu 1.
Fe + 2HCl ---> FeCl2 + H2 (1)
FexOy + 2yHCl ---> xFeCl2y/x + yH2O (2)
Gọi a, b tương ứng là số mol của Fe và FexOy trong hh. Theo pt (1) số mol a = số mol H2 = 0,1 mol. Số mol HCl đã p.ứ ở pt (1) = 0,2 mol.
Số mol HCl ban đầu = 14,6.200/100.36,5 = 0,8 mol.
Khối lượng dd A = 200 + 17,2 - 2.1 = 215,2 g. Khối lượng dd B = 215,2 + 33 = 248,2 g.
Số mol HCl còn dư sau phản ứng = 2,92.248,2/100.36,5 = 0,19856 mol \(\approx\) 0,2 mol. Như vậy số mol HCl đã tham gia p.ứ = 0,8 - 0,2 = 0,6 mol.
Mà HCl đã p.ứ ở pt (1) là 0,2 mol nên số mol HCl đã p.ứ ở pt(2) là 0,4 mol.
Theo pt(2) số mol FexOy = 0,4/2y = 0,2/y mol. Mà khối lượng FexOy = 17,2 - 5,6 = 11,6 g. Ta có: (56x + 16y).0,2/y = 11,6. Suy ra: 56x + 16y = 58y hay x:y = 3:4
Oxit cần tìm là: Fe3O4.

\(m_{KL\left(mỗi.phần\right)}=\dfrac{1}{2}.15,6=7,8\left(g\right)\)
- Phần 1:
\(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH:
\(Zn+2H_2SO_{4\left(đ,nóng\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\left(1\right)\\ Cu+2H_2SO_{4\left(đ,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\left(2\right)\\ 2Al+6H_2SO_{4\left(đ,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\left(3\right)\)
Theo PTHH (1,2, 3): \(n_{H_2O}=n_{H_2SO_4}=2n_{SO_2}=2.0,35=0,7\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_{KL}+m_{H_2SO_4}=m_{muối.sunfat}+m_{SO_2}+m_{H_2O}\)
=> mmuối sunfat = 7,8 + 0,7.98 - 0,35.64 - 0,7.18 = 41,4 (g)
\(\rightarrow m_{SO_4^{2-}}=41,4-7,8=33,6\left(g\right)\\ n_{SO_4^{2-}}=\dfrac{33,6}{96}=0,35\left(mol\right)\)
- Phần 2:
PTHH:
\(2Zn+O_2\underrightarrow{t^o}2ZnO\\ 2Cu+O_2\underrightarrow{t^o}2CuO\\ 4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(n_{O^{2-}}=n_{SO_4^{2-}}=0,35\left(mol\right)\\ \rightarrow m_{O^{2-}}=0,35.16=5,6\left(g\right)\\ \rightarrow m=5,6+7,8=13,4\left(g\right)\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

A là 1 mẫu hỗn hợp gồm Zn và Cu được chia đôi
=>Phần 1: HCl dư hòa tan hết Zn
\(\Rightarrow\left\{{}\begin{matrix}\text{mCu = 1}\\\text{mZn = a}\end{matrix}\right.\)
=>Phần 2: Thêm 4 gam Al vào X được Y
\(\Rightarrow\%Zn=\frac{a}{a+5}=\frac{a}{a+1}\text{– 0,3333}\)
—> a = 5
\(\Rightarrow\%Cu=\frac{1}{1+a}\text{ =16,67%}\)
ủa nếu bấm máy tính thì sẽ ra a=1 mà là 50% ó