Hợp chất Acó công thức MX\(_y\),trong đó M chiếm 46,67 về khối lượng.M là kim loại,là phi kim có 3 lớp e trong nguyên tử.Hạt nhân M có n-p=4.Hạt nhân X có m'=p'(n,p ,n',p' là số notron và proton của nguyên tử Mvà X).Tổng số proton trong MX\(_y\) là 58.Xác định nguyên tử M và X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$\dfrac{M}{Xy} = \dfrac{46,67}{53,33} \Rightarrow \dfrac{n + p}{y(n' + p')} = \dfrac{46,67}{53,33} = \dfrac{7}{8}$
Thay $n - p = 4$ và $n' = p'$ vào, ta có :
$\dfrac{2p+ 4}{2xp'} = \dfrac{7}{8} \Rightarrow 4(2p + 4) = 7xp'$
Tổng số proton trong MAx là 58 nên: p + xp’ = 58. Từ đây tìm được: p = 26 và xp’ = 32.
Do A là phi kim ở chu kì 3 nên 15 ≤ p’ ≤ 17. Vậy x = 2 và p’ = 16 thỏa mãn.
Vậy M là Fe và A là S; công thức của MAx là FeS2.
hnamyuh CTV, bn ơi cho mk hỏi là tại sao ta lại có tỉ số: \(\dfrac{M}{X_y}=\dfrac{46,67}{53,33}\) ??? Cám ơn bn trước!!!

Đáp án D
Trong hợp chất MAx, M chiếm 46,67% về khối lượng nên :
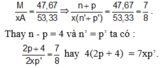
Tổng số proton trong MAx là 58 nên: p + xp’ = 58. Từ đây tìm được: p = 26 và xp’ = 32.
Do A là phi kim ở chu kì 3 nên 15 ≤ p’ ≤ 17. Vậy x = 2 và p’ = 16 thỏa mãn.
Vậy M là Fe và A là S; công thức của MAx là FeS2.

M chiếm 46,67% về khối lượng:

Quan sát – phân tích: Hệ 5 ẩn gồm 4 phương trình không thể giải thông thường để tìm nghiện vì ta cần phải rút gọn nghiệm: Phương trình (2) chứa ẩn ZM và x. ZA từ phương trình (1); (3); (4) ta có thể đưa về 1 phương trình chứa 2 ẩn ZM và x
Z A → Đưa về hệ phương trình 2 ẩn.
Ta đưa được về hệ sau
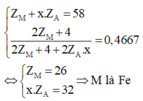
M là Fe nên x sẽ nhận giá trị từ 1 đến 3.
Từ x.ZA = 32 ta có các giá trị của ZA

Vậy H là FeS2
Đáp án A.

Câu 1,2
Cho nước vào hỗn hợp, lọc bỏ phần không tan
Cho thêm dung dịch CaCl2 tới dư vào, lọc bỏ phần không tan
$CaCl_2 + Na_2SO_4 \to CaSO_4 + 2NaCl$
$CaCl_2 + MgSO_4 \to CaSO_4 + MgCl_2$
Dung dịch gồm : NaCl,MgCl2,Na2SO4,CaCl2
Cho dung dịch NaOH dư vào, lọc bỏ phần không tan
$MgCl_2 + 2NaOH \to Mg(OH)_2 + 2NaCl$
Dung dịch gồm : NaCl,Na2SO4,NaOH,CaCl2
Cho thêm dung dịch H2SO4 tới dư vào, lọc bỏ phần không tan, cho bay hơi dung dịch
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$CaCl_2 + H_2SO_4 \to CaSO_4 + 2HCl$
Chất rắn khan gồm : Na2SO4,NaCl
Cho dung dịch BaCl2 tới dư vào, lọc dung dịch
$BaCl_2 + Na_2SO_4 \to BaSO_4 + 2NaCl$
Dung dịch gồm : BaCl2,NaCl
Cho dung dịch H2SO4 tới dư vào, cô cạn dung dịch . Ta được naCl tinh khiết
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
TK: nếu là 67 thì
1.1
M là Fe (26); A là S (16) công thức là FeS2
Giải thích các bước giải:
Ta có %M=46,67% -> %A=53,33%
Ta có : M=n+p; A=n'+p'
-> (n+p)/(x(n'+p'))=46,67/53,33=7:8
Vì n-p=4 -> n=4+p
-> (2p+4)/2xp'=7/8 -> 7xp'-8p=16
Tổng số proton =p+xp'=58 -> p=26; xp'=32
Vì A là phi kim thuộc chu kì 3 nên 15 <= p' <=17 (P; S; Cl)
Với x=2 -> p'=16
Vậy M là Fe; A là S công thức là FeS2
1.2
cho vào lượng dư dung dịch BaCl2
MgSO4+BaCl2=>BaSO4+MgCl2
lọc bỏ kết tủa tiếp tục cho vào lượng dư Na2CO3
MgCl2+Na2CO3=>MgCO3+2NaCl
BaCl2+Na2CO3=>BaCO3+2NaCl
CaCl2+Na2CO3=>CaCO3+2NaCl
lọc bỏ kết tủa, dung dịch gồm NaCl Na2CO3 dư
cho HCl dư vào
2HCl+Na2CO3=>2NaCl+H2O+CO2
đun nhẹ dung dịch cho HCl dư bay hơi cô cạn dung dịch thu được NaCl tinh khiết

Giả sử: M số proton và nơtron lần lượt là p và n
=> Khối lượng nguyên tử của M: mp.p+mn.n
X có số p và n lần lượt là p và n
=> Khối lượng nguyên tử của X là: mp.p +mn.n
( mp và mn lần lượt là khối lượng của 1 hạt proton và 1 hạt nơtron)
Mà mp =mn = 1,67.10^-27 nên
Khối lượng nguyên tử của M: mp.( n+p)
Khối lượng nguyên tử của X : mp.(n + p )
(+++: Vì khối lượng của 1 nguyên tử là tổng khối lượng của p, e và n, mà khối lượng của e không đáng kể nên khối lượng của nguyên tử có thể tính bằng khối lượng của p và n)
* ta có:
n-p = 4 <=> n=p+4 (1)
n =p (2)
p+ xp = 58 => xp = 58 - p (3)
* Hợp chất A có công thức MX(x) trong đó M chiếm 46,67% về khối lượng nên:
M / (M+xX) = 46,67/100 <=> [mp.(n+p)] / [mp.(n+p) + x.mp.(n +p )] = 46,67/100
<=> (n+p) / [(n+p) +x(n +p )] = 46,67/100 (4)
Thay (1), (2), (3) vào (4) ta giải ra được : p = 26 => Kim loại M chính là Fe
p=26 => n= 26 +4 = 30 và xp = 32
Với x=1 => p =32 => phi kim là Ge (loại )
Với x=2 => p =16 => phi kim là S( thuộc chu kì 3 nên thỏa mãn điều kiên=> chọn)
Vậy công thức của hợp chất A là: FeS2

Trong hợp chất MAx thì M chiếm 46,67% về khối lượng nên ta có:
\(\dfrac{M_X}{A}=\dfrac{46,67}{53,33}\)→\(\dfrac{n+p}{x\left(n'+p\right)}=\dfrac{7}{8}\)(1)
Thay n – p = 4 và n’ = p’ vào (1) ta có: \(\dfrac{2p+4}{2xp'}=\dfrac{7}{8}\)
Tổng số proton trong MAx là 58 nên p +xp’= 58 (2)
Giải (1) và (2) ta có p= 26 và xp’ = 32
Do A là phi kim ở chu kì 3 nên 15 ≤ p’≤17.
Vậy x =2 và p’=16 thỏa mãn
Vậy M là Fe và A là S. Công thức phân tử FeS2.



bạn ơi chỗ" ...M là kim loại , là phi kim có 3 lớp e..." hình như bạn nhầm ở đâu rồi nhé!!