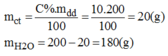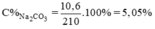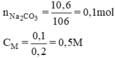1. Độ tan cảu 1 chất (.) nc là gì? Những yếu tố nào ảnh hưởng đến độ tan?
2. Nồng độ dung dịch cho bt những gì?
3. Cách pha chế dung dịch ntn?
4. Các kí hiệu sau cho ta bt điều gì:
SKNO3(20oC) = 31,6g , SKNO3(100oC) = 246g ,
SCuSO4(20oC) = 20,7g , SCuSO4(100oC) = 75,4g ,
SCO2(20oC, 1 atm) = 1,73g , SCO2(60oC, 1 atm) = 0.07g