Cho m gam gồm Fe, FeO, Fe2O3, Fe3O4 vào 400ml dd HCl 2M, sau phản ứng thu được 2,24 lít H2, ddY và 2,8 gam Fe không tan. Tìm m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Quy hỗn hợp ban đầu chỉ có Fe và O
Bảo toàn nguyên tố với clo
DD sau phản ứng chỉ có FeCl2 0,4 mol
=> m Fe ban đầu=0,4*56+2,8=25,2g
n O=1/2 n H+ =0,4
=> m=m Fe + m O=25,2+0,4*16=31,6g

Sau phản ứng còn 2,8g Fe nên dd Y chỉ chứa FeCl2
nHCl=0,8 mol
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Đáp án B

Đáp án : B
Vì có Fe dư => trong dung dịch chỉ chứa muối FeCl2
Bảo toàn nguyên tố Cl : nFeCl2 = ½ nHCl = 0,4 mol
Lại có nH2 = nFe + HCl = 0,1 mol
Coi hỗn hợp đầu gồm có Fe và O
Dựa vào phản ứng : 2H+ + O -> H2O
=> nHCl = 2nH2 + 2nO
=> nO = ½ [0,8 – 0,1.2 ] = 0,3 mol
=> m = mFe + mO = 56.0,4 + 2,8 + 16.0,3 = 30g

\(n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\)
\(n_{H^+} = n_{HCl} = 0,8(mol)\)
Coi X gồm Fe,O
2H+ + 2e → H2
0,2...........0,2......0,1..................(mol)
2H+ + O2- → H2O
0,6..........0,3.............................(mol)
Bảo toàn electron :
\(2n_{Fe} = 2n_{H_2} + 2n_O\\ \Rightarrow n_{Fe\ pư} = \dfrac{0,3.2+0,1.2}{2} = 0,4(mol)\)
Suy ra :
mX = mFe phản ứng + mO + mFe dư = 0,4.56 + 0,3.16 + 2,8 = 30 gam

Fe dư ⇒ HCl hết. nHCl = 0,8 mol; nH2 = 0,1 mol.
Bảo toàn nguyên tố Hidro:
nH2O = (0,8 - 0,1 × 2) ÷ 2 = 0,3 mol
Bảo toàn nguyên tố Clo: nFeCl2 = 0,4 mol.
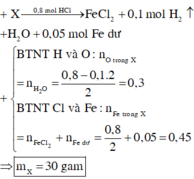
Quy X về Fe và O
⇒ ∑nFe = 0,4 + 2,8 ÷ 56 = 0,45 mol;
nO = nH2O = 0,3 mol.
⇒ m = 0,45 × 56 + 0,3 × 16 = 30(g).
Do HNO3 dư, bảo toàn electron:
3nFe = 2nO + nNO2 ⇒ nNO2 = 0,75 mol ⇒ V = 16,8 lít
Đáp án C

Chọn đáp án C
Fe dư ⇒ HCl hết. nHCl = 0,8 mol; nH2 = 0,1 mol. Bảo toàn nguyên tố Hidro:
nH2O = (0,8 - 0,1 × 2) ÷ 2 = 0,3 mol || Bảo toàn nguyên tố Clo: nFeCl2 = 0,4 mol.
Quy X về Fe và O ⇒ ∑nFe = 0,4 + 2,8 ÷ 56 = 0,45 mol; nO = nH2O = 0,3 mol.
⇒ m = 0,45 × 56 + 0,3 × 16 = 30(g). Do HNO3 dư, bảo toàn electron:
3nFe = 2nO + nNO2 ⇒ nNO2 = 0,75 mol ⇒ V = 16,8 lít ⇒ chọn C.