Cho 300ml dung dịch HCl 0,15M tác dụng với 200ml AgNO3 0,2M thu được m(g) kết tủa.
a. Tính giá trị m
b. Tính nồng độ mol/lít của các chất có trong dung dịch sau phản ứng
#Ai biết câu trả lời thì giúp mình vs ạ, mình cảm ơn trước
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{Ca\left(OH\right)_2}=0,3\left(mol\right)\\ n_{H_3PO_4}=0,3\left(mol\right)\\ Vì:\dfrac{n_{Ca\left(OH\right)_2}}{n_{H_3PO_4}}=\dfrac{0,3}{0,3}=1\\ \Rightarrow Tạo.1.muối:CaHPO_4\\ Ca\left(OH\right)_2+H_3PO_4\rightarrow CaHPO_4+2H_2O\\ m_{\downarrow}=0\\ n_{CaHPO_4}=n_{Ca\left(OH\right)_2}=0,3\left(mol\right)\\ C_{MddCaHPO_4}=\dfrac{0,3}{0,3+0,3}=0,5\left(M\right)\)

a) $Fe + 2HCl \to FeCl_2 + H_2$
b) $n_{HCl} = 0,2.0,3 = 0,06(mol)$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,03(mol)$
Suy ra :
$m = 0,03.56 = 1,68(gam)$
$V = 0,03.22,4 = 0,672(lít)$
b) $n_{FeCl_2} = \dfrac{1}{2}n_{HCl} = 0,03$
$C_{M_{FeCl_2}} = \dfrac{0,03}{0,2} = 0,15M$

\(n_{BaCl_2}=0.2\cdot0.5=0.1\left(mol\right)\)
\(BaCl_2+K_2SO_4\rightarrow BaSO_4+2KCl\)
\(0.1.............0.1.........................0.2\)
\(V_{dd_{K_2SO_4}}=\dfrac{0.1}{1}=0.1\left(l\right)\)
\(V_{dd}=0.2+0.1=0.3\left(l\right)\)
\(C_{M_{KCl}}=\dfrac{0.2}{0.3}=0.67\left(M\right)\)
Đổi 200ml = 0,2 lít
Ta có: \(n_{BaCl_2}=0,5.0,2=0,1\left(mol\right)\)
a. PTHH: \(BaCl_2+K_2SO_4--->BaSO_4\downarrow+2KCl\)
Theo PT: \(n_{K_2SO_4}=n_{BaCl_2}=0,1\left(mol\right)\)
\(\Rightarrow V_{dd_{K_2SO_4}}=\dfrac{0,1}{1}=0,1\left(lít\right)\)
b. Theo PT: \(n_{KCl}=2.n_{BaCl_2}=2.0,1=0,2\left(mol\right)\)
Ta có: \(V_{dd_{KCl}}=V_{dd_{BaCl_2}}=0,1\left(lít\right)\)
\(\Rightarrow C_{M_{KCl}}=\dfrac{0,2}{0,1}=2M\)

\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,1.1=0,1\left(mol\right)\)
PTHH :
\(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
trc p/u : 0,1 0,1
p/u : 0,1 0,05 0,05 0,1
sau p/u : 0 0,05 0,05 0,1
\(C_{M_{BaCl_2}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
\(C_{M_{Ba\left(OH\right)_2dư}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
\(m_{BaCl_2}=0,05.208=10,4\left(g\right)\)

\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\\ \)
\(n_{KOH}=2.0,3=0,6\left(mol\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+H_2O\\ Vì:\dfrac{0,6}{2}>\dfrac{0,2}{1}\\ \rightarrow KOHdư\\ n_{KOH\left(dư\right)}=0,6-0,2.2=0,2\left(mol\right)\\ n_{K_2SO_4}=n_{H_2SO_4}=0,2\left(mol\right)\\ V_{ddsau}=200+300=500\left(ml\right)=0,5\left(l\right)\\ C_{MddK_2SO_4}=\dfrac{0,2}{0,5}=0,4\left(M\right)\\ C_{MddKOH\left(dư\right)}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Em tham khảo. Cho anh hỏi em chưa hiểu chỗ nào, sao lại chưa biết làm nè? Vì bài này rất cơ bản nà

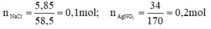
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 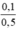 = 0,2 mol/l.
= 0,2 mol/l.