1 ,hoàt hoàn toàn 2,72gam hỗn hợp A gồm Fe và Fe2O3 bằng dung dịch H2SO4 đặc nóng thu được 672 ml khí SO2 (ở đktc) hấp thụ toàn bộ lượng khí SO2 đó vào bình đựng 200ml dd NaOH 0,5M thu được dd B
a, tính thành phần phần trăm theotính thành phần phần trăm theo khối lượng A
B, tính nồng độ mol các chất trong dd B
2, nhận biết 3 dd NaCL, Na2SO3, Na2SO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O\)(Phản ứng oxi hóa-khử)
\(Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\)
\(b) n_{SO_2} = \dfrac{672}{1000.22,4} = 0,03(mol)\\ n_{Fe}= \dfrac{2}{3}n_{SO_2} = 0,02(mol)\\ \%m_{Fe} = \dfrac{0,02.56}{2,72}.100\% = 41,18\%\\ \%m_{Fe_2O_3} = 100\% -41,18\% = 58,82\%\)

Đáp án : B
Nếu NaOH dư => n F e O H 3 = 0,2 mol
=> nFe(bd) = 0,2 mol
=> nO(bd) = 0,5 mol. Vô lý
(Vì số mol O trong oxit cao nhất là gấp 1,5 lần số mol Fe).
Vậy NaOH thiếu : 19,2 F e : a O : b
56a + 16b = 19,2
n H 2 S O 4 = 0 , 9
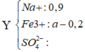
→ B T D T n S O 4 2 - = 0 , 3 + 3 a 2
→ B T N T . S n S O 2 = 0 , 9 - 0 , 3 + 3 a 2 a
6a – 2b = 1,5 ⇒ a = 0 , 3 b = 0 , 15 → V = 6 , 72







1, Tau phải bt Fe2O3 tác dụng vs dd H2SO4 đặc nóng thì sản phẩm khí thu được vẫn là H2 và ko có khí SO2.
do đó nFe=2/3 nSO2=0,02 (bạn biết pt ra rồi cân bằng là hiểu);
a,%Fe=0,02*56/2,72=41,18%;
%Fe2O3= 58,82%;
b, do nNaOH/nSO2= 10/3 >2 nên sản phẩm chỉ gồm muối trung hòa và NaOH dư;
ta có nNa2CO3 =nSO2= 0,03(mol);
CM(Na2CO3)= 0,03/0,2 =0,15(M);
CM(NaOH dư)=(0,1-0,06)/0,2=0,2 (M);
c; trích mấu thử đánh dấu :
dùng BaCl2 nhận ra NaCl vì không còn hiện tg còn lại xuất hiện kết tủa trắng.
2 chất còn lại thì dùng dd HCl nhận ra Na2SO3 vì sủi bọt khí Na2SO4 ko có hiện tg gì