Dung dịch A là hh rượu etylic và nước cho 6.4g A tác dụng với Na dư được 2.24 lít khí hidro ở điều kiện tự nhiên
a. Xđ độ rượu của dung dịch A. Biết Druou=0.8gg/ml D nước =1g/ml
b. Nếu dùng rượu 35° cho tác dụng với Na dư thù cần bao nhiêu gam để cũng thu được lượng hidro trên

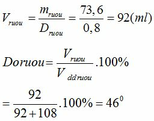
Đặt: nC2H5OH= x (mol), nH2O= y (mol)
C2H5OH + Na --> C2H5ONa + 1/2 H2(1)
Na + H2O --> NaOH + 1/2 H2(2)
mA= 46x + 18y= 6.4g (3)
nH2= 0.5 (x + y) = 2.24/22.4= 0.1
<=> x + y= 0.2 (4)
Giải pt (3), (4) có:
x= y= 0.1
mC2H5OH= 4.6g
mH2O= 1.8 g
Vhhr= Vr + Vn = 4.6/0.8 + 1.8= 7.55 ml
Dr= Vr/Vhhr * 100= 5.75/7.55 * 100= 76.15(độ)
b) Vì rượu 35 độ nên:
\(D_r=\frac{V_r}{V_{hhr}}\cdot100=35\)
\(100V_r=35\left(V_r+V_{nước}\right)\)
100Vr= 35Vr + 35Vn
\(\frac{Vr}{Vn}=\frac{35}{65}=\frac{7}{13}\)
<=> \(\frac{n_r}{n_n}=\frac{7}{13}\)
Theo (1) và (2)
nr + nn= 2nH2= 0.2
<=> nr=0.07 (mol)
mr=0.07 * 46=3.22g
nn=0.13 (mol)
mn=0.13 * 18= 2.34 (g)
mhhr=3.22 + 2.34=5.56 (g)
Chúc bạn học tốt <3
còn cánh giải ngắn dễ hiểu hơn hk bn