Hỗn hợp gồm 10g Al,Mg,Cu được hòa tan bằng dung dịch HCl dư. Sau phản ứng thu được 8,96 lít khí(đktc) , ddA và chất rắn B. lấy Bnung nóng ngoài không khí tới khối lượng không đổi được 2,75g chất rắn C
a, Tính phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu
b, Tính C\(_M\)của dd HCl biết V\(_{ddHCl}\)bằng 200ml


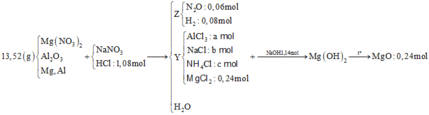


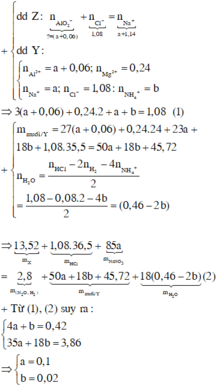
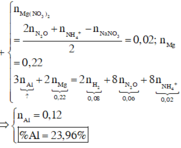
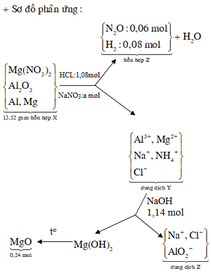

2Al + 6HCl => 2AlCl3 + 3H2
Mg + 2HCl => MgCl2 + H2
Chất rắn B là Cu (Vì Cu không tan trong HCl, Cu đứng sau H trong dãy hoạt động các ngto hóa học)
Cu + 1/2 O2 => CuO
nCuO = m/M = 2.75/80 = 0.034375
==> mCu = n.M = 2.2 (g)
==> mAl + mMg = 10 - 2.2 = 7.8
Gọi x,y lần lượt là số mol của Al và Mg
Ta có: 27x + 24y = 7.8; 1.5x + y = 0.4 = 8.96/22.4
Giải hệ phương trình ta được:
x = 0.2; y = 0.1
mAl = n.M = 0.2 x 27 = 5.4 (g)
mMg = n.M = 0.1x24 = 2.4 (g)
%Al = 54%, %Mg = 24%, %Cu = 22%
b/ nHCl = 3x + 2y = 0.8 (mol)
CM dd HCl = n/V = 0.8/0.2 = 4M