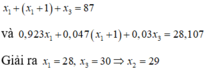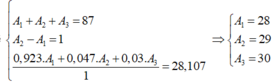Nguyên tố R có 3 đồng vị .Đồng vị thứ nhất chứa 12 nơtron, chiếm 78,6%.Đồng vị thứ hai chứa 13 nơtron,chiếm 10/5.Đồng vị thứ 3 chứa 14 nơtron, chiếm 11,4% về số nguyên tử.Biết nguyên tử khối trung bình của R là 24,348.Tính số khối mỗi đồng vị và viết kí hiệu mỗi đồng vị
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Ađồng vị 1 = 5 + 5 = 10
- Ađồng vị 2 = 5 + 1,2.5 = 11
=> \(\overline{M}=\dfrac{10.18,89+11.81,11}{100}=10,8111\left(g/mol\right)\)
=> A

Số proton của ba đồng vị không đổi, ta có:
Atb = 50% x A1 + 35% x A2 + 15% x A3 = 0.5 x (p + 5) + 0.35 x (p + 7) + 0.15 x (p + 8)
=> 12.15 = p + 6.15 => p = 6 (Cacbon)
Do m electron << m proton ~ m neutron nên m đồng vị coi như bằng tổng m proton + m neutron
=> A1 = 11, A2 = 12, A3 = 14

Chọn C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là:
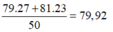

Đáp án C
Gọi số khối của X lần lượt là A1, A2, A3
Ta có hệ
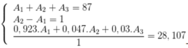
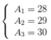

- Đồng vị thứ nhất có:A1=35+44=79
- Đồng vị thứ 2 có: A2=79+2=81
\(\overline{A}=\dfrac{27.79+23.81}{27+23}=79,92\)

Đáp án C
Gọi số khối của ba đồng vị tương ứng x1, x2, x3
Ta có x2= x1 +1
Theo đề ra ta có hệ phương trình