hòa tan một hợp chất X có chứa 71.43 phần trăm về khối lượng canxi và 28.57 phần trăm khối lượng oxi vào nước ta thu được dung dịch nước vôi trong Ca(OH)2.
a) Nếu sau phản ứng thu được 14.8g Ca(OH)2 thì cần bao nhiêu gam X
b) Tính thể tích nước cần dùng . Biết X có khối lượng mol là 56g và khối lượng riêng của nước là 1g/mol


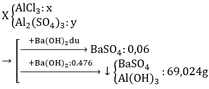

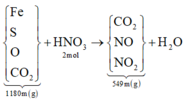
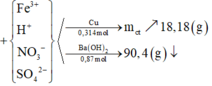

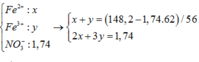



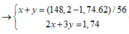
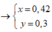
Gọi CTTQ: CaxOy
\(\dfrac{40x}{16y}=\dfrac{71,43}{28,57}\)
=> \(\dfrac{x}{y}=\dfrac{71,43.16}{28,57.40}=\dfrac{1}{1}\)
=> CTHH: CaO
a) nCa(OH)2 = 0,2 mol
Pt: CaO + H2O --> Ca(OH)2
.....0,2<----0,2<--------0,2........(mol)
mCaO cần = 0,2 . 56 = 11,2 (g)
b) V = \(\dfrac{0,2.18}{1}=3,6\left(ml\right)\)
Gọi CTHH của hợp chất X là CaxOy
Ta có: \(40x\div16y=71,43\div28,57\)
\(\Rightarrow x\div y=\dfrac{71,43}{40}\div\dfrac{28,57}{16}\)
\(\Rightarrow x\div y=1\div1\)
Vậy CTHH của hợp chất X là CaO
CaO + H2O → Ca(OH)2
a) \(n_{Ca\left(OH\right)_2}=\dfrac{14,8}{74}=0,2\left(mol\right)\)
Theo PT: \(n_{CaO}=n_{Ca\left(OH\right)_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{CaO}=0,2\times56=11,2\left(g\right)\)
b) \(n_{CaO}=\dfrac{56}{56}=1\left(mol\right)\)
Theo PT: \(n_{H_2O}=n_{CaO}=1\left(mol\right)\)
\(\Rightarrow m_{H_2O}=1\times18=18\left(g\right)\)
\(\Rightarrow V_{H_2O}=\dfrac{18}{1}=18\left(ml\right)\)