Giúp mình bài này nha, đây là hóa học nhưng vì ko biết làm mà lại cần gấp nên mình mới hỏi
Đề: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Biết lưu huỳnh cháy là tác dụng với oxi trong không khí.
a. Viết phương trình hóa học
b, Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1,5 mol nguyên tử lưu huỳnh.
Chú ý câu b, ko cần giải câu a cũng được nhé ~♥Thanh you♥~

 SO
SO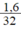 = 0,05 mol.
= 0,05 mol.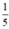 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là

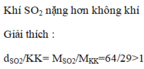
a) Phương trình phản ứng hóa học :
S + O2 →→ SO2
b) Số mol lưu huỳnh tham gia phản ứng :
nS=3,232=0,1(mol)nS=3,232=0,1(mol)
Theo phương trình, ta có : nSO2 = nS = nO2 = 0,1 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là :
VO2 = 22,4.0,1 = 2,24 (l)
Tương tự thể tích khí oxi cần dùng ở đktc là :
VO2 = 22,4.0,1 = 2,24 (l)
Vì khí oxi chiếm 20% về thể tích của không khí nên thể tích không khí cần dùng là :
Vkk = 5.VO2 = 5.2,24 = 11,2 (l)