III. AXIT SUNFURIC( H2SO4)
4. Sản xuất axit sunfuric
Câu hỏi :
1. Hãy cho biết quá trình sản xuất axit sunfuric từ lưu huỳnh gồm mấy công đoạn ? Đó là công đoạn nào?
2. Viết các PTHH của các phản ứng xảy ra đối với mỗi công đoạn đó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gồm 3 công đoạn
\(\left(1\right)S+O_2-^{t^o}\rightarrow SO_2\\ \left(2\right)2SO_2+O_2-^{t^o,V_2O_5}\rightarrow2SO_3\\ \left(3\right)SO_3+H_2O\rightarrow H_2SO_4\)

a) A là SO2: lưu huỳnh đi oxit => oxit axit
B là SO3 : lưu huỳnh tri oxit => oxit axit
b) \(S+O2-->SO2\)
\(2SO2+O2-->2SO3\)
\(SO3+H2O-->H2SO4\)

Khối lượng lưu huỳnh chứa trong 80 tấn quặng:
m S = 80x40/100 = 32 tấn
Điều chế H 2 SO 4 theo sơ đồ sau
S → SO 2 → SO 3 → H 2 SO 4
Ta thấy: Cứ 32g S thì sản xuất được 98g H 2 SO 4
⇒ m H 2 SO 4 = 32x98/32 = 98 tấn
Hiệu ứng phản ứng: H = 73,5/98 x 100 = 75%

Đề có phải là : ' Từ 80 tấn quặng Pirit chứa 40% lưu huỳnh , người ta sản xuất được 73,5 tấn axit sunfuric . '' đúng không

Đáp án C.
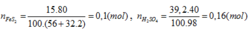
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

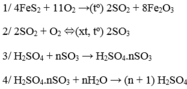
Võ Thành Công Danh không có gì