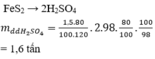tính lượng quặng (phirit) FeS2 9chuwas 80% FeS2) cần dùng để điều chế 9,8 tấn H2SO4 biết hiệu xuất của toàn bộ quá trình điều chế là 75%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)

a)
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
$2SO_2 + O_2 \xrightarrow{t^o,xt} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
b)
$m_{FeS_2} = 1000.60\% = 600(kg)$
$n_{FeS_2} = \dfrac{600}{120} = 5(kmol)$
$n_{FeS_2\ pư} = 5.80\% = 4(kmol)$
$n_{H_2SO_4} = 2n_{FeS_2} = 8(kmol)$
$m_{H_2SO_4} = 8.98 = 784(kg)$
4FeS2+11O2to→2Fe2O3+8SO2
4FeS2+11O2→to2Fe2O3+8SO2
2SO2+O2to,xt−−→2SO3
2SO2+O2→to,xt2SO3
SO3+H2O→H2SO4
SO3+H2O→H2SO4
b)
mFeS2=1000.60%=600(kg)
mFeS2=1000.60%=600(kg)
nFeS2=600120=5(kmol)
nFeS2=600120=5(kmol)
nFeS2 pư=5.80%=4(kmol)
nFeS2 pư=5.80%=4(kmol)
nH2SO4=2nFeS2=8(kmol)
nH2SO4=2nFeS2=8(kmol)
mH2SO4=8.98=784(kg)

Đáp án A.
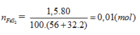
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
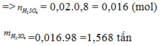

Ta có: $m_{FeS_2}=600(kg)\Rightarrow n_{FeS_2}=5000(mol)$
Bảo toàn S với hiệu suất 80% ta có: $n_{H_2SO_4}=5000.2.80\%=8000(mol)$
$\Rightarrow m_{ddH_2SO_4}=800(kg)$

4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
SO2 + O2 --to--> SO3
SO3 + H2O --> H2SO4
Theo phương trình, cứ 1 mol FeS2 thì tạo ra 2 mol H2SO4
=> cứ 0,245 mol FeS2 thì tạo ra 0,49 mol H2SO4
=> cứ 29,4g FeS2 thì tạo ra 48,02g H2SO4
=> cứ 29,4g FeS2 thì tạo ra 49g dd H2SO4 98%
=> cứ 29,4 tấn FeS2 thì tạo ra 49 tấn dd H2SO4 98%
Do hiệu suất của quá trình là 78%
=> mFeS2 (thực tế) = \(\dfrac{29,4.100}{78}=37,692\left(tấn\right)\)

Đáp án C
FeS2 → Fe → thép không gỉ.
Khối lượng quặng thực tế: 12 . 0 , 74 . 120 56 . 0 , 6 . 0 , 8 = 3 , 7 ( tấn )