Cho m (g) Na vào 200ml dung dịch chứa hỗn hợp HCl 1M và AlCl3 1M thu được 7,8g kết tủa. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n HCl = 0,2.1 = 0,2(mol)
n AlCl3 = 0,2.1 = 0,2(mol)
n Al(OH)3 = 7,8/78 = 0,1(mol)
2Na + 2HCl ----> 2NaCl + H2
0,2____0,2
2Na + 2H2O ---> 2NaOH + H2
3NaOH + AlCl3 ---> Al(OH)3 + 3NaCl
NaOH + Al(OH)3 ---> NaAlO2 + 2H2O........(*)
Xét TH1 không có phản ứng (*) xảy ra:
2Na + 2HCl ----> 2NaCl + H2
0,2____0,2
2Na + 2H2O ---> 2NaOH + H2
__0,3________________0,3
3NaOH + AlCl3 ---> Al(OH)3 + 3NaCl
___0,3__________________0,1
=> n Na = 0,2 + 0,3 = 0,5 (mol)
m Na = 0,5.23= 11,5(g)
Xét TH2 phản ứng (*) xảy ra:
2Na + 2HCl ----> 2NaCl + H2
0,2____0,2
2Na + 2H2O ---> 2NaOH + H2
__0,7______________0,7
3NaOH + AlCl3 ---> Al(OH)3 + 3NaCl
__0,6_______0,2__________0,2
NaOH + Al(OH)3 ---> NaAlO2 + 2H2O........(*)
0,1________0,2-0,1
n Al(OH)3 [pư với NaOH] = 0,2 - 0,1 = 0,1 (mol)
n NaOH = 0,6 + 0,1 = 0,7 mol
n Na = 0,2 + 0,7 = 0,9 mol
m Na = 0,9.23 =20,7(g)

Đáp án A
Khi cho hỗn họp gồm Na2O và A12O3 có phản ứng:
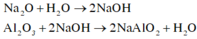
Vì sau một thời gian cho HCl vào dung dịch A mới xuất hiện kết tủa nên A gồm NaA1O2 và NaOH dư
Thứ tự các phản ứng xảy ra:
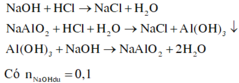
Vì khi cho 200ml hoặc 600ml dung dịch HCl 1M đều thu được a gam kết tủa nên khi cho 200ml dung dịch HCl thì chưa có sự hòa tan kết tủa và khi cho 600ml dung dịch HCl thì đã có sự hòa tan kết tủa.
Do đó:
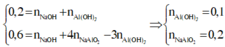
Áp dụng định luật bảo toàn nguyên tố cho Al và Na có
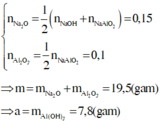

PTHH :
(1) 3 NaOH + AlCl3 -> 3NaCl + Al(OH)3
0,36<---0,12---------------> 0,12
(2) Al(OH)3 + NaOH -> NaAlO2 + 2H2O
0,02------> 0,02
nAlCl3= 0,12 (mol)
nAl(OH)3 (kết tủa) = 0,1 mol
nAl(OH)3 (2) = 0,12 - 0,1 = 0,02 mol
nNaOH= 0,36 + 0,02= 0,38 mol
x = 0,38/ 0,2 = 1,9

Đáp án B
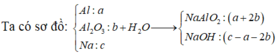
Khi cho 0,06 mol HCl ⇒ m gam kết tủa. Thêm tiếp vào (0,13–0,06) = 0,07 mol thì số mol kết tủa giảm 0,01 mol.
⇒ Khi cho 0,06 mol HCl vào thì kết tủa chưa đạt cực đại. Với 0,13 mol HCl thì số mol kết tủa đã đạt cực đại và bị hòa tan lại.
⇒ Sau khi phản ứng với 0,06 mol HCl thì số mol NaAlO2 còn lại = 0 , 07 - 0 , 01 × 3 4 = 0 , 01 m o l

Chọn đáp án B
Nhận xét nhanh
+ Vì hỗn hợp Na và Al (tỉ lệ mol 1:1) nên dung dịch X chỉ có NaAlO2.
+ Vì lượng HCl tăng 1,5 lần mà lượng kết tủa tăng chưa đến 1,5 lần.Nên lần 1 kết tủa chưa cực đại và lần 2 kết tủa đã bị tan 1 phần.
Ta có
![]()
![]()
Với thí nghiệm 2
![]()
![]()
![]()
![]()

Bắt đầu xuất hiện kết tủa n H C l = n N a O H ( d u ) = 0 , 1 S ố m o l H C l s a u k h i p h ả n ứ n g v ớ i N a O H n H C l ( 1 ) = 0 , 2 - 0 , 1 = 0 , 1 ; n H C l ( 2 ) = 0 , 6 - 0 , 1 = 0 , 5
Do khi cho vào 200ml hoặc 600ml HCl thì đều thu được cùng một lượng kết tủa nên ở TN1 kết tủa chưa tan, ở TN2 kết
tủa tan 1 phần
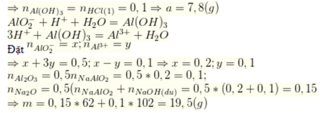
Ta có: \(n_{HCl}=0,2\cdot1=0,2mol\\ n_{AlCl_3}=0,2\cdot1=0,2mol\\ n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1mol\)
Xét trường hợp 1: Kết tủa chưa tan (Muối Nhôm dư)
Các phản ứng xảy ra:
\(2Na+2HCl\rightarrow2NaCl+H_2\uparrow\left(1\right)\)
0,2 0,2 (mol)
\(2Na+2H_2O\rightarrow2NaOH+H_2\uparrow\left(2\right)\)
0,3 ← 0,3 (mol)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\left(3\right)\)
0,1 ← 0,3 ← 0,1 (mol)
\(n_{Na}=0,2+0,3=0,5mol\Rightarrow m_{Na}=23\cdot0,5=11,5g\)
Xét trường hợp 2: Kết tủa tan một phần (Muối Nhôm hết)
Các phản ứng xảy ra:
\(2Na+2HCl\rightarrow2NaCl+H_2\uparrow\left(1\right)\)
0,2 0,2 (mol)
\(2Na+2H_2O\rightarrow2NaOH+H_2\uparrow\left(2\right)\)
0,7 ← 0,7 (mol)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\left(3\right)\)
0,2 ← 0,6 ← 0,2 (mol)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\left(4\right)\)
0,1 0,1 0,1 (mol)
\(n_{Na}=0,2+0,7=0,9mol\Rightarrow m_{Na}=23\cdot0,9=20,7g\)