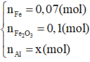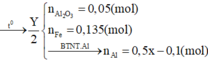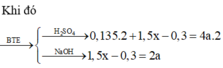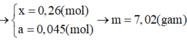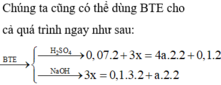Hỗn hợp A gồm có Al và Pb3O4, nung A ở nhiệt độ cao để Phản ứng xảy ra hoàn tàn thu được hỗn hợp B nghiền nhỏ B chia thành 2 phần.
- Phần 1 ít cho tác dụng với NaOH dư được 1,44 l H2 ở đktc. Tách riêng chất rắn không tan đem hòa tan trong dung dịch HCl dư thu được 1,088 l H2 ở đktc.
- Phần 2 nhiều cho tá dụng với dung dịch HCl thu được 9,408 l khí H2 ở đktc. Tính khối lượng của hỗn hợp A và % các chất trong hỗn hợp A.