Hh khí gồm CO, CO2, SO2 (hh A). Lập PTHH xảy ra khi cho A td với:
a. dd NaOH dư
b. dd H2S
c. dd Ba(OH)2 không dư
d. Trộn A với O2 dư, đốt nóng tạo ra khí X. Dẫn X vào dd H2SO4 90% thu đc khí Y & chất lỏng Z.
e. dd brom vừa đủ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Rắn X phải có A1 dư vì chỉ có A1 mới phản ứng với dung dịch NaOH tạo khí H2. Mặt khác do phản ứng hoàn toàn nên Fe3O4 hết.
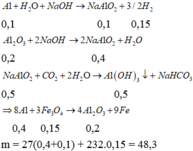

\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
\(n_{NaOH}=0,25.1=0,25\left(mol\right)\)
Cho X vào dung dịch `H_2SO_4` loãng:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,025<-----------------------0,025
a. \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{56.0,025.100\%}{11,8}=11,86\%\\\%m_{Cu}=\dfrac{\left(11,8-0,025.56\right).100\%}{11,8}=88,14\%\end{matrix}\right.\)
b. \(n_{Cu}=\dfrac{11,8-0,025.56}{64}=0,1625\left(mol\right)\)
Cũng lượng X trên cho vào dung dịch `H_2SO_4` đặc nóng:
Giả sử Fe tác dụng hết với dung dịch \(H_2SO_{4.đn}\)
\(2Fe+6H_2SO_{4.đn}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,025----------------------------------->0,0375
\(Cu+2H_2SO_{4.đn}\rightarrow CuSO_4+SO_2+2H_2O\)
0,1625--------------------------->0,1625
\(\Sigma n_{SO_2}=0,0375+0,1625=0,2\left(mol\right)\)
Có: \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,25}{0,2}=1,25\)
=> Phản ứng giữa `NaOH` và `SO_2` tạo muối axit trước (tỉ lệ 1:1)
\(SO_2+NaOH\rightarrow NaHSO_3\)
0,2---->0,2------->0,2
Xét \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\Rightarrow\) NaOH dư.
\(n_{NaOH.dư}=0,25-0,2=0,05\left(mol\right)\)
\(NaOH+NaHSO_3\rightarrow Na_2SO_3+H_2O\)
0,05----->0,05---------->0,05
Xét \(\dfrac{0,05}{1}< \dfrac{0,2}{1}\Rightarrow NaHSO_3.dư\)
Sau phản ứng thu được: \(\left\{{}\begin{matrix}n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\\n_{Na_2SO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,15.104+0,05.126=21,9=m_{muối.thu.được.theo.đề}\)
=> Giả sử đúng.
\(\Rightarrow V=V_{SO_2}=0,2.22,4=4,48\left(l\right)\)

a) 3,6 g
m=1,97(g)
VCO==20%
VCO2=20%
VH2=60%
Giải thích các bước giải:
2H2O+C->CO2+2H2
H2O+C->CO+H2
A: CO (y mol) H2(2x+y mol) CO2(x mol)+Ba(OH)2=>nkt BaCO3 x mol
CO (y mol) H2 (2x+y mol)+FeO->CO2 +B
B+H2SO4=>nSO2=0,065mol mà nH2SO4 phản ứng=0,14
=>B có oxi=>nO=0,14-0,13=0,01mol
nFe=(0,065x2+0,01x2)/3=0,05mol
=>mFeO=0,05x72=3,6g
CO2+Ca(OH)2->CaCO3 0,01mol
nCO2=0,01=>y=0,01
mặt khác y+2x+y=0,05-0,01=>x=0,01mol
m=197x0,01=1,97(g)
nhh=0,01+0,03+0,01=0,05(mol)
VCO=0,01/0,05x100=20%
VCO2=0,01/0,05x100=20%
VH2=60%
nguồn mạng nha.
\(n_{SO2}=\dfrac{1,456}{22,4}=0.065\left(mol\right);n_{CaCO_3}=\dfrac{1}{100}=0,01\left(mol\right)\)
Ta có : PTHH
\(2Fe+6H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
Thấy \(n_{H_2SO_4}:n_{SO_2}=\dfrac{0,14}{6}>\dfrac{0,065}{3}\Rightarrow\) chất rắn B có FeO dư
PTHH \(2FeO+4H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
Đặt số mol Fe và FeOdư lần lượt là a và b (a,b>0)
có \(\left\{{}\begin{matrix}3a+2b=0,14\\1,5a+0,5b=0,065\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,04\\b=0,01\end{matrix}\right.\)
\(\Rightarrow\sum n_{FeO}=n_{Fe}+n_{FeOdu}=0,05\left(mol\right)\) (bảo toàn nguyên tố Fe)
\(\Rightarrow m_{FeO}=0,05\times56=2,8\left(g\right)\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\) \(\Rightarrow n_{CO_2}=n_{CaCO_3}=0,01\left(mol\right)\)
\(FeO+CO\rightarrow Fe+CO_2\) \(\Rightarrow n_{CO}=n_{CO_2}=0,01mol\)
bạn xem lại đề bài nhé ý b không giải đc đâu
a;
2NaOH + CO2 -> Na2CO3 + H2O
2NaOH + SO2 -> Na2SO3 + H2
b;
SO2 + 2H2S -> 3S + 2H2O
c;
Ba(OH)2 + 2CO2 -> Ba(HCO3)2
Ba(OH)2 + 2SO2 -> Ba(HSO3)2
d;
2CO + O2 -> 2CO2
2SO2 + O2 -> 2SO3
SO3 + H2O -> H2SO4
e;
SO2 + Br2 + 2H2O -> 2HBr + H2SO4
Tại sao Ba(OH)2 + CO2 ----> Ba(HCO3)2 ạ?
Ba(OH)2 + CO2 ----> BaCO3 + H2O có được không ạ?