cho 11,2 gam kim loại tác dụng hết với H2SO4 đặc nóng thu đc 6,72 lít khí SO2 tên kim loại là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Gọi hóa trị của kim loại là a.
nSO2 = 0,3 mol
Bảo toàn e: nX.a = 2. nSO2
=> nX = 0,6/a
Mặt khác mX = 11,2 => MX = 56a/3
Với a = 3 MX = 56 (Fe)

Đáp án D
Số mol các chất là:
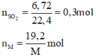
Gọi hoá trị của M là n
Sơ đồ phản ứng: M 0 + H 2 S + 6 2 O 4 ( đặc ) → M + N 2 ( SO 4 ) n + S + 4 O 2 + H 2 O
Các quá trình nhường, nhận electron:
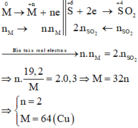

\(n_{H2\left(dktc\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_R=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
⇒ \(M_R=\dfrac{5,4}{0,2}=27\left(dvc\right)\)
Vậy kim loại R là nhôm
b) \(2Al+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(n_{SO2}=\dfrac{0,3.3}{2}=0,3\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt
a) PTHH: \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) \(\Rightarrow n_R=0,2\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{5,4}{0,2}=27\) \(\Rightarrow\) R là Nhôm (Al)
b) PTHH: \(2Al+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Theo PTHH: \(n_{SO_2}=0,3\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,3\cdot22,4=6,72\left(l\right)\)

$n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$2Fe +6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$n_{SO_2} = \dfrac{3}{2}n_{Fe} = 0,3(mol)$
$n_{SO_2\ hao\ hụt} = 0,3.3\% = 0,009(mol)$
$V_{SO_2} = (0,3 - 0,009).22,4 = 6,5184(lít)$
2Fe+6H2SO4→Fe2(SO4)3+3SO2+6H2O
nFe=0,2mol
→nSO2=3/2nFe=0,3mol
→VSO2=0,3×22,4−3%=6,69l

TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`
bài này thiếu dữ kiện : \(SO_2\) phải ở điều kiện tiêu chuẩn
\(ptpư:X+H_2SO_4\rightarrow ddmuối+SO_2+H_2O\)
ta có : \(n_{SO_2}=\dfrac{6,72}{22,4}=0,3mol\)
đặt \(x=n_X\)
quá trình OXH : \(\overset{0}{\dfrac{X}{x}}\rightarrow\overset{+2}{X}+\overset{ }{\dfrac{2e}{2x}}\)
quá trình khử : \(\overset{+6}{S}+\overset{ }{\dfrac{2e}{0,6}}\rightarrow\overset{+4}{\dfrac{S}{0,3}}\)
ta có : \(\sum n_{echo}=\sum n_{enhận}\) \(\Leftrightarrow2x=0,6\Leftrightarrow x=\dfrac{0,6}{2}=0,3\)
\(\Rightarrow M_X=\dfrac{m_X}{n_X}=\dfrac{11,2}{0,3}\simeq37,34\)
\(\Rightarrow\) kim loại cần tìm là ?? ?
đề có sai số liệu nào không bn
có: nSO2 = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
PT: M + H2SO4 \(\xrightarrow[]{}\) M2(SO4)n + SO2 + H2O
nM = x (mol)
ADĐL bảo toàn e, có:
\(\dfrac{M^0}{n}\rightarrow M^{+n}+\dfrac{n\left(e\right)}{x.n}\)
\(S^{+6}+\dfrac{2e}{0,6e}\rightarrow\dfrac{S^{+4}}{0,3e}\)
\(\Rightarrow\) x.n = 0,6 \(\Rightarrow x=\dfrac{0,6}{n}\)
\(M_{M_{ }}=\dfrac{11,2n}{0,6}=\dfrac{56}{3}\approx18,67\)
1
M
\(\Rightarrow\) Vậy kim loại cần tìm là Fe (III)