Một hỗn hợp gồm Zn và Fe có khối lượng là 37,2 gam . Hòa tan hỗn hợp này trong 2 lít dung dịch H2SO4 0,5M
a) Chứng tỏ rằng hỗn hợp này tan hết ?
b) Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượng H2SO4 vẫn như cũ thì hỗn hợp mới này có tan hết hay không?
c) Trong trường hợp (a) hãy tính khối lượng mỗi kim loại trong hỗn hợp biết rằng lượng H2 sinh ra trong phản ứng vừa đủ tác dụng với 48 gam CuO?

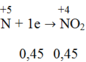
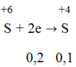

Zn+H2SO4--->ZnSO4+H2
x______x_______x_____x
Fe+H2SO4--->FeSO4+H2
y____y_________y____y
Ta có: 65x+56y=37,2
Giả sự hỗn hợp chỉ chứa toàn Zn
65(x+y)>37,2
=>x+y>0,57(1)
Giả sự hỗn hợp chỉ chứa toàn Fe
56(x+y)<37,2
=>x+y<0,66(2)
Từ (1) và (2) =>0,57<x+y<0,66
Mà theo các pt: nH2SO4=x+y=0,5.2=1(mol)
===>Hỗn hợp tan hết,axit dư
b) Dùng lượng Zn và Fe gấp đôi
Ta có: 1,14<x+y<1,32
Mà H2SO4 vẫn giữu nguyên 1 mol
===>Hỗn hợp k tan hết
c) nCuO=48/80=0,6(mol)
H2+CuO--->Cu+H2O
x+y__x+y
Hệ pt:
\(\left\{{}\begin{matrix}x+y=0,6\\65x+56y=37,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,4\\y=0,2\end{matrix}\right.\)
=>mZn=0,4.65=26(g)
=>mFe=0,2.56=11,2(g)