X và Y là hai hợp châts đều có tỉ khối với H2 là 14. Đốt cháy X thu được sản phẩm lafCO2. Đốt cháy 1,4 g Y thu được sản phẩm gồm 4,4 g CO2 và 3,6 gam H2O. tìm CTHH của X và Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Ta có: MA = MB = 14.2 = 28 (g/mol)
Mà đốt A chỉ thu CO2 ⇒ A là CO.
- Ta có: \(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\Rightarrow n_H=0,1.2=0,2\left(mol\right)\)
⇒ mC + mH = 0,1.12 + 0,2.1 = 1,4 (g) = mB
→ B chỉ chứa C và H.
Gọi CTPT của B là CxHy.
⇒ x:y = 0,1:0,2 = 1:2
→ CTPT của B có dạng (CH2)n
\(\Rightarrow n=\dfrac{28}{12+2}=2\)
Vậy: B là C2H4.
- A là hợp chất vô cơ, B là hợp chất hữu cơ.

Ta có M A = M B = 14 x 2 = 28 (gam).
A là hợp chất khi đốt chỉ tạo ra CO 2 . Vậy A phải chứa cacbon và oxi. Mặt khác, M A = 28 gam → công thức của A là CO.
B khi cháy sinh ra CO 2 và H 2 O, vậy trong B có cacbon và hiđro.
Ta có m C = 4,4/44 x 12 = 1,2g
m H = 1,8/18 x 2 = 0,2g
Vậy m B = m C + m H = 1,2 + 0,2 = 1,4 (gam).
=> Trong B chỉ có 2 nguyên tố là C và H.
Gọi công thức phân tử của B là C x H y , ta có :
4 C x H y + (4x +y) O 2 → 4x CO 2 + 2y H 2 O
n C x H y = 1,4/28 = 0,05mol
=> x = 2 ; y = 4. Công thức của B là C 2 H 4

Đáp án C
nA = 0,05
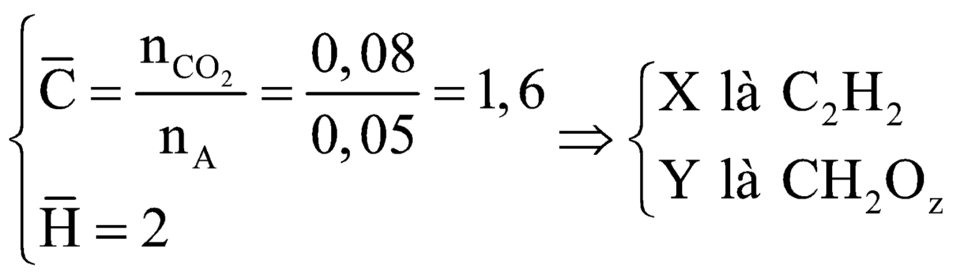
Áp dụng định luật bảo toàn nguyên tố C được:
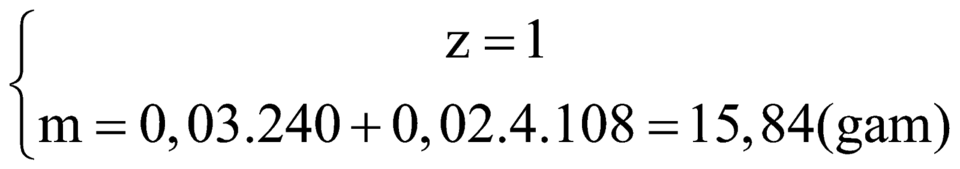

Giải thích:
nCO2 = 0,2 mol ; nH2O = 0,2 mol
Bảo toàn nguyên tố : nC = 0,2 ; nH = 0,4
=> mX = mC + mH + mO => nO = 0,1 mol
=> nC : nH : nO = 0,2 : 0,4 : 0,1 = 2 : 4 : 1
Vì X + NaOH tạo muối axit hữu cơ => X là este
=> C4H8O2.
TQ : RCOOR’ + NaOH -> RCOONa + R’OH
Vì : mmuối > meste => MR’ < MNa = 23 => R’ là CH3-
Vậy este là : C2H5COOCH3 (metyl propionat)
Đáp án A

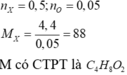
Câu này gọi công thức của \(\left\{{}\begin{matrix}X:C_aH_b\\Y:C_xH_yO_z\end{matrix}\right.\)
Theo đề bài ta có:
\(M_X=14.2=28=12a+16b\)
\(\Rightarrow0< b< \dfrac{28}{16}=1,75\)
\(\Rightarrow\left\{{}\begin{matrix}a=1\\b=1\end{matrix}\right.\)
\(\Rightarrow X:CO\)
Tương tự tìm ra Y.