Hòa tan hoàn toàn 7.8g hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7.0g so với ban đầu . số mol HCl tham gia pứ là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cho vào 7,8 g đáng lẽ khối lượng dung dịch sẽ tăng 7,8 gam nhưng chỉ tăng 7g chứng tỏ có 0,8 g chất khí thoát ra đó chính là khối lượng H2
Mg+2HCl\(\rightarrow\)MgCl2+H2
2Al+6HCl\(\rightarrow\)2AlCl3+3H2
\(n_{H_2}=\dfrac{0,8}{2}=0,4mol\)
Gọi số mol Mg là x, số mol Al là y.Ta có hệ phương trình:
24x+27y=7,8
x+1,5y=0,4
Giải ra x=0,1, y=0,2
mAl=27x=0,2.27=5,4 gam
Đáp án B

\(n_{H_2} = \dfrac{15,6-14}{2} = 0,8(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Mg + 2HCl \to MgCl_2 + H_2\)
Gọi \(n_{Al} = a \ mol;n_{Mg} = b\ mol\)
Ta có :
\(\left\{{}\begin{matrix}27a+24b=15,6\\1,5a+b=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,4\\b=0,2\end{matrix}\right.\)
Vậy :
\(\%m_{Al} = \dfrac{0,4.27}{15,6}.100\% = 69,23\%\\ \%m_{Mg} = 100\% - 69,23\% = 30,77\%\)

Mg + 2HCl \(\rightarrow\) MgCl2 + H2 (1)
Al + 3HCl \(\rightarrow\) AlCl3 + \(\dfrac{3}{2}\)H2 (2)
Đặt nMg=a
nAl=b
Ta có
24a+27b=7.8 g (3)
\(\Rightarrow\) 0,8g mất đi là do H2 bay hơi \(\Rightarrow n_{H_2}=\dfrac{0,8}{2}=0,4\left(mol\right)\)
\(\Rightarrow\) a+3/2b=0.4 (4)
Giải hệ 3 và 4 ta có:
a=0,1;b=0,2
Theo PTHH 1 và 2 ta có;
nHCl(1)=2nMg=0,2(mol)
nHCl(2)=3nAl=0,6(mol)
\(\sum n_{HCl}=0,2+0,6=0,8\left(mol\right)\)
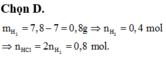

Mg + 2HCl →→ MgCl2 + H2 (1)
Al + 3HCl →→ AlCl3 + 3232H2 (2)
Đặt nMg=a
nAl=b
Ta có
24a+27b=7.8 g (3)
⇒⇒ 0,8g mất đi là do H2 bay hơi ⇒nH2=0,82=0,4(mol)⇒nH2=0,82=0,4(mol)
⇒⇒ a+3/2b=0.4 (4)
Giải hệ 3 và 4 ta có:
a=0,1;b=0,2
Theo PTHH 1 và 2 ta có;
nHCl(1)=2nMg=0,2(mol)
nHCl(2)=3nAl=0,6(mol)
∑nHCl=0,2+0,6=0,8(mol)