hợp chất khí x gồm nguyên tố phi kim hóa trị VI và oxi.Bt thể tích của 16g x gấp đôi thể tích của 4,4 g co2 (các khí đó ở cùng đktc) tìm cthh của x
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu1) nCO2 =m/M=11/44=0,25(mol)
nH2= 9.1023/6.1023=1,5(mol)
VH2 =n.22,4=1,5.22,4=33,6(l)

CT tổng quát giữa X(III) và O(II) là \(X_2O_3\)
\(\rightarrow M_{X_2O_3}=\frac{m}{M}=\frac{8}{0,125}=64g/mol\)
\(\rightarrow2M_X+3M_O=64\)
\(\rightarrow2M_X+3.16=64\)
\(\rightarrow M_X=8g/mol\)
Vậy không có khí X và CTHH nào thoả mãn
Với X(IV) \(\rightarrow CTTQ:XO_2\)
\(M_{XO_2}=64g/mol\)
\(\rightarrow M_X+2M_O=64\)
\(\rightarrow M_X+2.16=64\)
\(\rightarrow M_X=32g/mol\)
\(\rightarrow X:S\)
Vậy CTHC là \(SO_2\)

Đáp án A

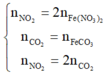
![]()

n S O 2 = 8 , 75 % n Y → b = 8 , 75 % ( 3 a + b + 4 c ) B T N T ( O ) : 3 a + 6 a + 2 c = 3 a + 1 , 5 b + 2 a + 2 b + 4 a → c = 1 , 75 a
→ b = 7 8 a
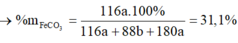

Để giải bài toán này, ta sẽ sử dụng các công thức và quy tắc của hóa học.
Gọi số mol của RO2 trong hỗn hợp (X) là n1 và số mol của O2 là n2. Theo đề bài, tỉ lệ số mol giữa RO2 và O2 là 2:3, ta có:
n1 : n2 = 2 : 3
Gọi khối lượng mol của RO2 là m1 và khối lượng mol của O2 là m2. Ta biết rằng khối lượng mol của metan (CH4) là gấp 2,35 lần khối lượng mol của hỗn hợp (X), vì vậy:
m1 + m2 = 2,35m
Theo quy tắc Avogadro, số mol và thể tích của một khí có tỉ lệ thuận với nhau (ở cùng điều kiện nhiệt độ và áp suất), vì vậy:
V1/V2 = n1/n2
Với V1 là thể tích của hỗn hợp (X) và V2 là thể tích của metan.
Từ các phương trình trên, ta có thể giải hệ phương trình để tìm ra các giá trị của n1, n2, m1, m2 và V1.

Bài 1:
\(n_{O_2}=\dfrac{0,9.10^{23}}{6.10^{23}}=0,15(mol)\\ V_{O_2}=0,15.22,4=3,36(l)\\ n_{Cl_2}=\dfrac{7,1}{71}=0,1(mol)\\ V_{Cl_2}=0,1.22,4=2,24(l)\)
Bài 2:
\(M_{X(A_2O_3)}=\dfrac{32}{0,2}=160(g/mol)\\ \Rightarrow 2M_A+48=160\\ \Rightarrow M_A=56(g/mol)(Fe)\\ \Rightarrow CTHH_X:Fe_2O_3\)
Gọi CTHH của khí X là $RO_3$
Ta có:
\(M_{RO_3}=R+48=\dfrac{16}{\dfrac{4,4}{44}.2}=80\Rightarrow R=32\left(S\right)\)
Vậy CTHH khí X là $SO_3$