Bài 1: Cho 26,7g AlCl2 tác dụng đủ với 300ml dung dịch NaOH xM. Sau phản ứng thu được a (g) kết tủa, lọc kết tủa, đun nóng thu b (g) muối. Xác định x, a, b.
Bài 2: Trộn 300ml H2SO4 1M với 200ml NaOH 1,2M. Dung dịch sau phản ứng làm quỳ tím chuyển màu gì? Giải thích?
Bài 3: Nhúng thanh sắt vào dung dịch 100ml CuSO4 1M. Sau phản ứng nhấc thanh sắt ra cân nặng. Hỏi cân nặng thanh sắt tăng lên bao nhiêu g?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Ca\left(OH\right)_2}=0,3\left(mol\right)\\ n_{H_3PO_4}=0,3\left(mol\right)\\ Vì:\dfrac{n_{Ca\left(OH\right)_2}}{n_{H_3PO_4}}=\dfrac{0,3}{0,3}=1\\ \Rightarrow Tạo.1.muối:CaHPO_4\\ Ca\left(OH\right)_2+H_3PO_4\rightarrow CaHPO_4+2H_2O\\ m_{\downarrow}=0\\ n_{CaHPO_4}=n_{Ca\left(OH\right)_2}=0,3\left(mol\right)\\ C_{MddCaHPO_4}=\dfrac{0,3}{0,3+0,3}=0,5\left(M\right)\)

\(\text{nMgCl2 = 0,2.0,15 = 0,03 mol}\)
\(\text{a) (1) MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl}\)
\(\text{ (2) Mg(OH)2 --to--> MgO + H2O}\)
b)
Từ các PTHH: nMgO(2) = nMg(OH)2 (2) = nMg(OH)2 (1) = nMgCl2 = 0,03 mol
\(\text{→ m = mMgO = 0,03.40 = 1,2 (g)}\)
c) Theo PTHH (1): nNaCl = 2nMgCl2 = 2.0,03 = 0,06 mol
\(\text{→ CM NaCl = n : V = 0,06 : (0,2 + 0,3) = 0,12M}\)
a) MgCl2+2NaOH---->Mg(OH)2+2NaCl
Mg(OH)2--->MgO+H2O
b) n MgCl2=0,2.0,15=0,03(mol)
Theo pthh1
n Mg(OH)2=n MgCl2=0,03(mol0
Theo pthh2
n MgO=n Mg(OH)2=0,03(mol)
m MgO=0,03.40=1,2(g)
c) V dd =0,2+0,3=0,5(l)
Theo pthh2
n NaCl=2nMgCl2=0,06(mol)
CM NaCl=\(\frac{0,06}{0,5}=0,12\left(M\right)\)

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
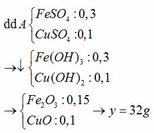

a) PTHH: \(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_3\downarrow\)
\(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
b) Ta có: \(n_{FeCl_3}=0,3\cdot0,5=0,15\left(mol\right)\)
\(\Rightarrow n_{NaOH}=0,45mol\) \(\Rightarrow V_{ddNaOH}=\dfrac{0,45}{0,25}=1,8\left(l\right)\)
c) Theo PTHH: \(n_{NaCl}=n_{NaOH}=0,45mol\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,45}{2,1}\approx0,21\left(M\right)\)
(Coi như thể tích dd thay đổi không đáng kể)
d) Theo PTHH: \(n_{H_2SO_4}=\dfrac{3}{2}n_{Fe\left(OH\right)_3}=\dfrac{3}{2}n_{FeCl_3}=0,225mol\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,225\cdot98}{20\%}=110,25\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{110,25}{1,14}\approx96,71\left(ml\right)\)

\(a,PTHH:3NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\downarrow\\ 2Fe\left(OH\right)_3\rightarrow^{t^o}Fe_2O_3+3H_2O\uparrow\\ b,n_{FeCl_3}=1,5\cdot0,2=0,3\left(mol\right)\\ \Rightarrow n_{NaOH}=3n_{FeCl_3}=0,9\left(mol\right)\\ \Rightarrow V_{dd_{NaOH}}=\dfrac{0,9}{2}=0,45\left(l\right)\)
Theo đề: \(\left\{{}\begin{matrix}X:Fe\left(OH\right)_3\\A:NaCl\\Y:Fe_2O_3\end{matrix}\right.\)
Theo PT: \(n_{NaCl}=3n_{FeCl_3}=0,9\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,9}{0,45+0,2}\approx1,4M\)
\(c,\) Theo PT: \(n_{Fe\left(OH\right)_3}=n_{FeCl_3}=0,3\left(mol\right);n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_3}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_X=m_{Fe\left(OH\right)_3}=0,3\cdot107=32,1\left(g\right)\\m_Y=m_{Fe_2O_3}=0,15\cdot160=24\left(g\right)\end{matrix}\right.\)
Bài 2: Trộn 300ml H2SO4 1M với 200ml NaOH 1,2M. Dung dịch sau phản ứng làm quỳ tím chuyển màu gì? Giải thích?
____
nH2SO4 = 0,3mol
H2SO4 -----> 2H+ + SO4(2-)
0,3 ----------> 0,6 mol
nNaOH = 0,24 mol
NaOH ----> Na+ + OH-
0,24 ------> 0,24 mol
(Nếu thành thạo r thì bỏ qua bước viết pt điện li suy ra luôn số mol ion)
Sau khi trộn:
H+ + OH- --------> H2O
Trước pu 0,6 0,24
Pu 0,24 <------- 0,24
Còn 0,36 0
Vậy H+ dư sau pu
=> pH < 7 => Qùy chuyển đỏ