Cho 400ml dung dịch hỗn hợp Al2(SO4)3 và Fe2(SO4)3 có tỉ lệ số mol Al2SO4 : Fe2(SO4)3=1:2 tác dụng với dung dịch NH3 dư. Lọc kết tủa nung ngoài không khí đến khối lượng không đổi thu được 4,22 gam kết tủa. Tính nồng độ ion SO42- trong dung dịch ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

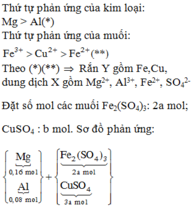
Chọn đáp án C.
Hỗn hợp sau nung chứa 2 oxit là MgO và Fe2O3
chứng tỏ Mg và Zn phản ứng hết, Fe2(SO4)3 và CuSO4 phản ứng hết, FeSO4 còn dư.
Đặt y là số mol FeSO4 đã phản ứng
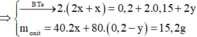

⇒ m C u + m F e = 17 , 44 g

Đáp án C
Hỗn hợp sau nung chứa 2 oxit là MgO và Fe2O3, chứng tỏ Mg và Zn phản ứng hết, Fe2(SO4)3 và CuSO4 phản ứng hết, FeSO4 còn dư.
Đặt y là số mol FeSO4 đã phản ứng
=> 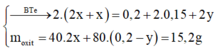
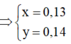 (1)
(1)
![]() = 17,44 (g)
= 17,44 (g)

Đáp án C
Ta có ![]()
![]()
=> mcác kim loại = ![]()
Chuỗi phản ứng: ![]()
![]()
![]()
![]()
=> nO oxi hóa FeO thành Fe2O3 =1,57 - 1,37 = 0,2 mol
Phản ứng: ![]()
= 0,2.2 = 0,4 mol
![]()
![]()

\(n_{NaOH}=0,4mol\)
\(n_{Fe_2\left(SO_4\right)_3}=0,16.0,125=0,02mol\)
\(n_{Al_2\left(SO_4\right)_3}=0,16.0,25=0,04mol\)
Fe2(SO4)3+6NaOH\(\rightarrow\)2Fe(OH)3+3Na2SO4
0,02
Al2(SO4)3+6NaOH\(\rightarrow\)2Al(OH)3+3Na2SO4
0,04
Số mol NaOH(Pu)=6(0,02+0,04)=0,36mol
Số mol NaOH(dư)=0,4-0,36=0,04mol
Số mol Al(OH)3=0,04.2=0,08mol
Al(OH)3+NaOH\(\rightarrow\)NaAlO2+2H2O
Dựa vào tỉ lệ mol ta thấy Al(OH)3 còn dư=0,08-0,04=0,04mol
2Al(OH)3\(\rightarrow\)Al2O3+3H2O
Số mol Al2O3=0,04:2=0,02mol
2Fe(OH)3\(\rightarrow\)Fe2O3+3H2O
Số mol Fe2O3=0,02mol
mChất rắn=0,02(102+160)=5,24g
phương trình của NaOH và Al2(SO4)3 theo mình là sai
8NaOH + Al2(SO4)3  2NaAlO2 + 3Na2SO4 + 4H2O
2NaAlO2 + 3Na2SO4 + 4H2O

Đáp án C
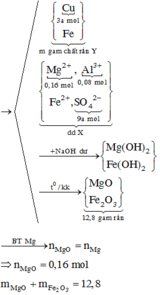
Ta có:
![]()
Do nung kết tủa ngoài không khí thu được 15,2 gam hỗn hợp 2 oxit nên 2 oxit là MgO và Fe2O3 (Zn(OH)2 bị hòa tan trong NaOH dư) do vậy Cu hết và Fe3+ hết
Gọi số mol Zn là a → số mol Mg là 2a.
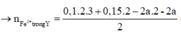
= 0,45 - 3a
Vậy oxit gồm 2a mol MgO và 0,225-1,5a mol Fe2O3
=> 40.2a + 160(0,225-1,5a) = 15,2
Giải được: a=0,13
Rắn Z thu được gồm Cu 0,15 mol và Fe 0,14 mol (bảo toàn Fe) => m = 17,44 gam

Đáp án C
Ta có: n F e 2 ( S O 4 ) 3 = 0 , 1 m o l ; n C u S O 4 = 0 , 15 m o l
Do nung kết tủa ngoài không khí thu được 15,2 gam hỗn hợp 2 oxit nên 2 oxit là MgO và Fe2O3 (Zn(OH)2 bị hòa tan trong NaOH dư) do vậy Cu hết và Fe3+ hết
Gọi số mol Zn là a → số mol Mg là 2a.
→ n F e 3 + t r o n g Y = 0 , 1 . 2 . 3 + 0 , 15 . 2 - 2 a . 2 - 2 a 2 = 0 , 45 - 3 a
Vậy oxit gồm 2a mol MgO và 0,225-1,5a mol Fe2O3
=> 40.2a+160(0,225-1,5a)= 15,2
Giải được: a=0,13
Rắn Z thu được gồm Cu 0,15 mol và Fe 0,14 mol (bảo toàn Fe)
→ m = 17 , 44 g a m


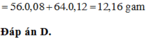
-Gọi x là số mol Al2(SO4)3, suy ra số mol Fe2(SO4)3 là 2x
Fe2(SO4)3+6NH3+6H2O\(\rightarrow\)2Fe(OH)3\(\downarrow\)+3(NH4)2SO4(1)
Al2(SO4)3 +6NH3+ 6H2O \(\rightarrow\) 2Al(OH)3\(\downarrow\)+3(NH4)2SO4 (2)
Al(OH)3 + NH3 \(\rightarrow\) NH4AlO2 + H2O(3)
- Kết tủa thu được chỉ có Fe(OH)3
2Fe(OH)3\(\rightarrow\)Fe2O3+3H2O(4)
\(n_{Fe_2O_3}=\dfrac{4,22}{160}=0,026375mol\)
Theo PTHH(1,4) ta có:
\(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}\rightarrow2x=0,026375\)
\(\rightarrow\)x=0,0131875mol
\(n_{SO_4^{2-}}=3n_{Al_2\left(SO_4\right)_3}+3n_{Fe_2\left(SO_4\right)_3}=3x+3.2x=9x=9.0,0131875=0,1186875mol\approx0,12mol\)
[SO42-]=\(\dfrac{0,12}{0,4}=0,3M\)