Hỗn hợp 2 oxit của hai kim loại kế tiếp nhau trong nhóm II của bảng hệ thống tuần hoàn. Cho 8,8 g hỗn hợp hai oxit trên tan hết trong dd HCl 2M vừa đủ, sau phản ứng thêm dư thấy tách ra 57,4 g kết tủa. Tìm 2 kim loại trên, 2 oxit tương ứng và khối lượng mỗi oxit?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{HCl}=\dfrac{219.10}{100.36,5}=0,6\left(mol\right)\)
ACO3 + 2HCl --> ACl2 + CO2 + H2O
BCO3 + 2HCl --> BCl2 + CO2 + H2O
=> nHCl = 2.nCO2 = 2.nH2O
=> nCO2 = nH2O = 0,3 (mol)
Theo ĐLBTKL: mhh ban đầu + mHCl = mhh muối clorua + mCO2 + mH2O
=> mhh muối clorua = 26,8 + 0,6.36,5 - 0,3.44 - 0,3.18 = 30,1 (g)

Gọi công thức chung của 2 kim loại là R
PTHH: \(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\) \(\Rightarrow n_R=0,3\left(mol\right)\)
\(\Rightarrow\overline{M}_R=\dfrac{8,5}{0,3}\approx28,33\left(đvC\right)\), mà 2 kim loại thuộc 2 chu kì liên tiếp
\(\Rightarrow\) 2 Kim loại cần tìm là Natri và Kali
Đặt \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\dfrac{1}{2}a+\dfrac{1}{2}b=0,15\left(mol\right)\)
Ta lập được HPT:
\(\left\{{}\begin{matrix}23a+39b=8,5\\\dfrac{1}{2}a+\dfrac{1}{2}b=0,15\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,2\cdot23=4,6\left(g\right)\\m_K=0,1\cdot39=3,9\left(g\right)\end{matrix}\right.\)

a, Đặt kim loại trung bình là R \(\rightarrow \) R hóa trị II
\(PTHH:R+2HCl\to RCl_2+H_2\\ \Rightarrow n_R=n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ \Rightarrow M_R=\dfrac{6,5}{0,2}=32,5(g/mol)\)
Vậy 2 KL đó là Mg (24) và Ca (40)
\(b,\) Đặt \((n_{Mg};n_{Ca})=(x;y)(mol)\)
\(\Rightarrow \begin{cases} 24x+40y=6,5\\ x+y=n_{H_2}=0,2 \end{cases}\Rightarrow \begin{cases} x=0,09375(mol)\\ y=0,10625(mol) \end{cases}\\ \Rightarrow \begin{cases} m_{Mg}=2,25(g)\\ m_{Ca}=4,25(g) \end{cases}\)

Đáp án A.
Gọi M là nguyên tử khối trung bình của 2 kim loại A và B
Khi đó công thức oxit chung là ![]()
Ta có phản ứng
![]()
0,03 0,18
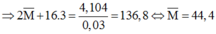
Suy ra phải có 1 kim loại có nguyên tử khối bé hơn 44,4 và 1 kim loại có nguyên tử khối lớn hơn 44,4
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối nhỏ hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Al (A = 27; Z = 13)
Kim loại còn lại có số hiệu nguyên tử bằng (A = 56)
Tổng số khối khi đó là 27 + 56 = 83
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối lớn hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Ga (A = 70; Z = 31)
Kim loại còn lại có số hiệu nguyên tử:


Dựa vào bảng tuần hoàn ta tìm được X là Al và Y là Fe.
Gọi số mol các chất trong hỗn hợp: Al = a( mol); Fe = b (mol).
Ta có: 27a + 56b = 8,3 (1)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
a 3a 1,5a
Fe + 2HCl → FeCl2 + H2 (3)
b 2b b
Khối lượng dung dịch sau phản ứng tăng thêm 7,8 gam nên: 8,3 - mH2 = 7,8.
Vậy: mH2 = 0,5 gam → nH2 = 0,25 mol → 1,5a + b = 0,25 (4)
Từ (1) và (4) ta tìm được: a = 0,1 mol; b = 0,1 mol.
mAl = 27.0,1 = 2,7 (gam)
mFe = 56.0,1 = 5,6 (gam);
VHCl = (3a + 2b) : 0,5 = 1 (lit).
Gọi công thức 2 oxit: RO
RO+2HCl\(\rightarrow\)RCl2+H2O
RCl2+AgNO3\(\rightarrow\)R(NO3)2+2AgCl
\(n_{AgCl}=\dfrac{57,4}{143,5}=0,4mol\)
\(n_{RO}=n_{RCl_2}=\dfrac{1}{2}n_{AgCl}=0,2mol\)
RO=\(\dfrac{8,8}{0,2}=44\) hay R+16=44 suy ra R=28
2 kim loại kế tiếp nhau trong nhóm II nên 2 kim loại là: Mg(24) và Ca(40). CTHH 2 oxit: MgO(xmol) và CaO(ymol)
x+y=0,2
\(\dfrac{24x+40y}{x+y}=28\rightarrow24x+40y=28.0,2=5,6\)
Giải hệ có được: x=0,15 và 0,05
mMgO=0,15.40=6 gam
mCaO=0,05.56=2,8 gam