Cho 20g hỗn hợp bột Fe và Fe2O3 vào dd CuSO4 0,5M . Phản ứng xong thu được 22g chất rắn. Phần trăm khối lượng của Fe và Fe2O3 trong hỗn hợp là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Các phản ứng xảy ra:
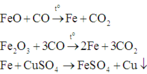
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
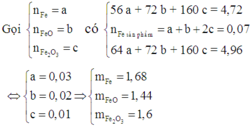

Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là
A. 1,68; 1,44; 1,6
B. 1,6; 1,54; 1,64

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]() khối lượng rắn giảm
khối lượng rắn giảm
![]() khối lượng rắn tăng
khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt nZn = x; nFe = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 65)y = 8y
m tăng = m giảm =>x = 8y =>%mZn = 65x/(65x - 56y)x100% = 90,27%

Đáp án A
► Đặt nZn = x; nFe = y. Do Cu2+ dư nên ta có:
– Zn + Cu2+ → Zn2+ + Cu ||⇒ tăng (65 – 64)x = x (g).
– Fe + Cu2+ → Fe2+ + Cu ||⇒ giảm (64 – 56)y = 8y (g).
Do mrắn = mkim loại ban đầu = m(g) ⇒ x = 8y.
||⇒ %mZn = 65 × 8y ÷ (65 × 8y + 56y) × 100% = 90,27%

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]()
=> Khối lượng rắn giảm
![]() => Khối lượng rắn tăng
=> Khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt n Z n = x ; n F e = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 56)y = 8y
m tăng = m giảm => x = 8y => %mZn = 65x : (65x - 56y).100% = 90,27%


- Độ tăng khối lượng=22-20=2g
Fe+CuSO4\(\rightarrow\)FeSO4+Cu
Gọi số mol Fe=x\(\rightarrow\)số mol Cu=xmol
64x-56x=2 hay 8x=2 suy ra x=0,25mol
mFe=0,25.56=14g\(\rightarrow\)\(m_{Fe_2O_3}=20-14=6g\)
%Fe=\(\dfrac{14.100}{20}=70\%\)
%Fe2O3=30%