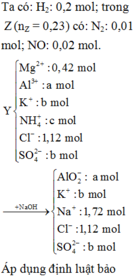
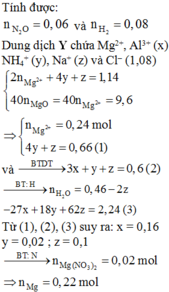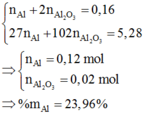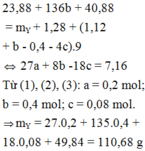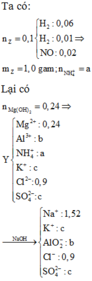hòa tan m(g) hỗn hợp gồm al(no3)2 và zn(no3)2 có tỉ lệ mol là 3:2 vào nc dư thu đc dd X.Cho 96ml đ naoh 1M vào X thấy có 2a mol hỗn hợp kết tủa. Lọc kết tủa, cho dd còn lại tác dụng với naoh thấy có kết tủa nz. Mặt khác, cho 208ml đ naoh 1M vào X thấy xuất hiện a mol kết tủa. Giả sử tốc độ pứ như nhau. Hãy tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án A
mCu tối đa = 0,2´0,75´64 = 9,6 gam và mFe tối đa = 0,2´56 = 11,2 gam
Vì 9,6 + 11,2 > 14,08 Þ Fe2+ dư, Mg và Al bị oxi hóa hết Þ nFe trong Y = (14,08 – 9,6)/56 = 0,08
Đặt nMg = 4a Þ nAl = a; BTE Þ 2´4a + 3a = 0,2 + 0,15´2 + 0,08´2 Þ a = 0,06
Þ Trong X chứa 0,24 mol Mg2+ + 0,06 mol Al3+ + 0,12 mol Fe2+
Þ Chất rắn sau cùng gồm: 0,24 mol MgO và 0,06 mol Fe2O3
Vậy mChất rắn = 0,24´40 + 0,06´160 = 19,2 gam

Đáp án C
Hết 0,12 mol NaOH mới có kết tủa chứng tỏ Y có H+. Vậy n(H+) = 0,12 mol
Chất rắn thu được khi cho tác dụng với NaOH là Fe(OH)2 và Fe(OH)3. (Nếu xét chỉ có Fe(OH)2 hay chỉ có Fe(OH)3 thì khối lượng rắn thu được không thỏa mãn)
Y có H+ , có Fe2+ nên NO3- hết.
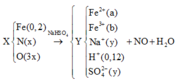
Y → N a O H F e ( O H ) 2 ( a ) F e ( O H ) 3 ( b ) → B T N T ( F e ) : a + b = 0 , 2 90 a + 107 b = 19 , 36 → a = 0 , 12 b = 0 , 08
BTDT: y-0,6
BTNT(H): n H 2 O = n N a H S O 4 - n H + 2 = 0 . 24
BTNT(N):
n N O = x B T N T ( O ) : 3 x = x + 0 , 24 → x = 0 , 12
Cho X vào nước, Fe sẽ tác dụng với Fe3+. Do chất rắn dư, chứng tỏ, dung dịch sau chỉ có Fe(NO3)2
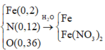
→ n F e ( N O 3 ) 2 = 0 , 12 2 = 0 , 06
B T N T ( F e ) : n F e = 0 , 14 → m F e = 7 , 84