1) Nung 16,8 gam hỗn hợp X gồm MgCO3 và CaCO3 đến khối lượng không đổi, rồi dẫn khí thu được vào 180 ml dung dịch Ba(OH)2 1M thu được 33,49 gam kết tủa. Xác định % khối lượng các chất trong X.
2) Một hỗn hợp X gồm MgO và Fe2O3 trong đó oxi chiếm 32,5% về khối lượng. Để hoà tan hết 3,84 gam cần bao nhiêu ml dung dịch H2SO4 1M.






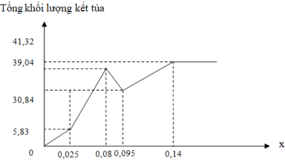
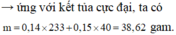


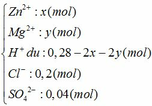

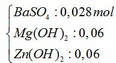
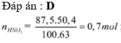
1) Số mol Ba\(\left(OH\right)_2=0,18\left(mol\right)\)
Số mol Ba\(CO_3=0,17\left(mol\right)\)
\(MgCo_3\underrightarrow{t^o}MgO+CO_2\)
\(CaCo_3\underrightarrow{t^o}CaO+CO_2\)
Ta có : 84x + 100y = 16.8 (I)
Vì \(n_{BaCO_3}\curlyvee n_{Ba\left(OH\right)_2}\)( cái đầu bn cho mũi nhọn về phái bên trái nhen ) nên bài toán xảy ra 2 trường hợp :
TH1 : Thiếu CO2 , dư Ba(OH)2
\(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
Ta có : x + y = 0,17 (II)
Từ I và II ta có hệ phương trình :
\(\left\{{}\begin{matrix}84x+100y=16,8\\x+y=0,17\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}0,0125\\0,1575\end{matrix}\right.\)
Thành phần %2 muối :
\(\%MgCO_3=6.25\%;\%CaCO_3=93.75\%\)
TH2: dư CO2 , kết của tân một phần .
( TỰ lm tiếp nhen )