Cho 1 lượng khí Clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối kim loại hóa trị I . Hãy xác định của kim loại I và muối kim loại đó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2A+Cl2->2ACl
nA=nACl
mA/mACl=MA/MA+35.5
Theo bài ra:mA:mACl=9.2:23.4
->MA/MA+35.5=9.2/23.4
->MA=23(g/mol)->A là Natri
theo đề bài, khí là Cl2
gọi Kim loại đó là A
PTK của nó là MA
số mol của nó là a
PT: 2A+CL2=>2ACl
nACl=nA=a
theo bài ra ta có :
MA*a=9,2
(MA+35,5)*a=23,4
giải hệ này ra sẽ tính được a=0,4
từ đó tính được PTK của kim loại = 23 => đó là Na

Giải
Đặt M là KHHH của kim loại hoá trị I.
PTHH: 2M + Cl2 → 2MCl
2M(g) (2M + 71)g
9,2g 23,4g
Ta có: 23,4 x 2M = 9,2(2M + 71)
Suy ra: M = 23.
Kim loại có khối lượng nguyên tử bằng 23 là Na.
Vậy muối thu được là: NaCl.
Bài này trên lp mk hc rồi,bn cứ yên tâm đi nha ![]()

- Gọi kí hiệu và nguyên tử khối của kim loại là M.
Phương trình hoá học :
2M + Cl 2 → 2MCl
9,2 x 2(M + 35,5) = 2M x 23,4
653,2 = 28,4M
M = 23. Vậy kim loại M là kim loại natri (Na).
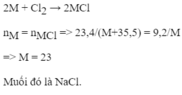
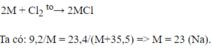
Gọi a là số mol khí Clo phản ứng
Phương trình phản ứng
\(Cl_2+2X\rightarrow2XCl\)
a------>2a------->2a
.........\(\dfrac{9,2}{M_X}\)......\(\dfrac{23,4}{M_X+35,5}\)
Từ phương trình ta thấy số mol của Kim loại và muối bằng nhau nên:
=> 9,2MX + 326,6 = 23,4MX
=> 326,6 = 14,2MX
=> MX =23 ( là kim loại Na )
Vậy kim loại đó là Natri
Muối của kim loại là NaCl
Giải:
Gọi kim loại hóa trị I là A
PTHH: 2A + Cl2 ----> 2ACl
Theo định luật bảo toàn khối lượng:
mA + m\(Cl_2\)= m\(ACl\)
=> m\(Cl_2\)= \(m_{ACl}-m_A\)= \(23,4-9,2=14,2\left(gam\right)\)
=> n\(Cl_2\) = \(\dfrac{14,2}{71}=0,2\left(mol\right)\)
Theo PTHH: nA= 2n\(Cl_2\) = 2.0,2 = 0,4 (mol)
MA = \(\dfrac{9,2}{0,4}\)= 23 (g/mol)
=> Kim loại hóa trị I là: Na
=> Muối của kim loại là: NaCl