. Cho m gam Al vào dung dịch HNO3 loãng, đến khi nhôm tan hết thu được dung dịch A và 0,672 lít khí N2 (đktc). Cô cạn cẩn thận dung dịch A thu được 40,74 gam muối khan. Tính giá trị của m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: nAl= 0,18 mol= nAl(NO3)3; nNO= 0,1 mol
QT cho e :
Al→ Al3++ 3e (1)
0,18 0,54 mol
QT nhận e :
N+5+ 3e → NO (2)
0,3 0,1
Nếu chỉ có quá trình nhận e (2) thì số mol e cho khác số mol e nhận
Do đó phải có quá trình :
NO3-+ 8e+ 10H+ → NH4+ + 3H2O (3)
0,24→ 0,03
Theo ĐL BT e : ne cho= ne nhận nên 0,54= 0,3+ ne nhận ở quá trình 3
→ ne nhận ở quá trình 3= 0,24 mol
Muối khan thu được có Al(NO3)3 : 0,18 mol; NH4NO3: 0,03 mol
→m=0,18. 213 + 0,03.80=40,74 gam
Đáp án A

Đáp án B
(*) Phương pháp: Bảo toàn e, Bảo toàn khối lượng
- Lời giải: Vì KL +HNO3 không có khí thoát ra sản phẩm khử là NH4NO3
TQ:
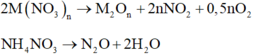
nO(x) = 0,61364m /16(mol)
![]()
Ta có
![]()
![]()
![]()
Bảo toàn khối lượng mX – mran = mNH4NO3 + mNO2 + mO2
![]()
![]()

Giải thích:
Vì KL + HNO3 không có khí thoát ra => sản phẩm khử là NH4NO3
TQ : 2M(NO3)n ---> M2On + 2nNO2 + 0,5nO2
NH4NO3 ---> N2O + 2H2O
nO(X) = 0,61364m/16 (mol)
nNO3 = ne tđ + nNH4NO3 = 1/3nO(X) = 0,61364m/48 (mol)
Ta có : ne tđ = 8nNH4NO3
=> ne tđ = 0,61364m/54 = nNO2 = 4nO2 ; nNH4NO3 = 0,61364m/432
=> nO2 = 0,61364m/216 (mol)
Bảo toàn khối lượng : mX - mrắn = mNH4NO3 + mNO2 + mO2
=> m – 19,2 = 80. 0,61364m/432 + 46. 0,61364m/54 + 32. 0,61364m/216
=> m = 70,4g
Đáp án B

Đáp án B
(*) Phương pháp: Bảo toàn e, Bảo toàn khối lượng
- Lời giải: Vì KL + H N O 3 không có khí thoát ra
⇒ sản phẩm khử là N H 4 N O 3
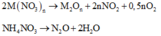
n O ( X ) = 0 , 61364 m / 16 ( m o l )
n N O 3 = n e t d + n N H 4 N O 3 = 1 3 n O ( X ) = 0 , 61364 / 48 ( m o l )
⇒ n O 2 = 0 , 61364 m / 216 ( m o l )
Bảo toàn khối lượng
m X - m r a n = m N H 4 N O 3 + m N O 2 + m O 2
![]()
⇒ m = 70 , 4 g

Vận dụng phương pháp tăng giảm khối lượng.
Theo phương trình ta có:
Cứ 1 mol muối C O 3 2 - → 2 mol Cl- + lmol CO2 lượng muối tăng 71 - 60 = 11 g
Theo đề số mol CO2 thoát ra là 0,03 thì khối lượng muối tăng 11.0,03 = 0,33 g
Vậy m muối clorua = 14 + 0,33 = 14,33 g.
Đáp án B

Đáp án A
Mg → Mg+2 +2e
Al→ Al+3 +3e
Zn → Zn+2 + 2e
N+5 + 8e → N-3
Muối có Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3 → rắn nung nóng có MgO, ZnO, Al2O3
Đặt khối lượng kim loại trong 19,2 g rắn trên là x g và số mol O là y mol → x + 16y =19,2 mol
Trong muối nitrat của kim loại trong X có nNO3= 2y
Bảo toàn e có nNH4NO3 = y . 2 : 8 = 0,25y
Trong muối khan của dung dịch X có %O = ![]()
Nên x = 12,8 và y =0,4
→ m = x + 62.2y + 80.0,25y =70,4

Đáp án A
Mg → Mg+2 +2e
Al→ Al+3 +3e
Zn → Zn+2 + 2e
N+5 + 8e → N-3
Muối có Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3 → rắn nung nóng có MgO, ZnO, Al2O3
Đặt khối lượng kim loại trong 19,2 g rắn trên là x g và số mol O là y mol → x + 16y =19,2 mol
Trong muối nitrat của kim loại trong X có nNO3= 2y
Bảo toàn e có nNH4NO3 = y . 2 : 8 = 0,25y
Trong muối khan của dung dịch X có %O =
![]()
Nên x = 12,8 và y =0,4
→ m = x + 62.2y + 80.0,25y =70,4
bảo toàn Electron: \(Al\rightarrow Al^{3+}+3e\)
\(5N^{5+}+10e\rightarrow N_2\)
\(n_{N_2}=0,03mol\)
\(\rightarrow3n_{Al}=10n_{N_2}\)
\(\rightarrow n_{Al}=0,1mol\)
\(\rightarrow n_{Al\left(NO_3\right)_3}=n_{Al}=0,1mol\)
\(\rightarrow m_{Al\left(NO_3\right)_3}=21,3g< 40,74g\)
Vậy có muối \(NH_4NO_3\) tạo thành
\(Al\rightarrow Al^{3+}+3e\)
\(2N^{5+}+10e\rightarrow N_2\)
\(2N^{5+}+8e\rightarrow NH_4^+\)
\(\rightarrow3n_{Al}=10n_{N_2}+8n_{NH_4NO_3}\)
\(\rightarrow3n_{Al}-8n_{NH_4NO_3}=0,3\)
\(m_{Al\left(NO_3\right)_2}+m_{NH_4NO_3}=40,74mol\)
\(\rightarrow213n_{Al}+80n_{NH_4NO_3}=40,74\)
Giải hệ phương trình: \(\hept{\begin{cases}3n_{Al}-8n_{NH_4NO_3}=0,3\\213n_{Al}+80n_{NH_4NO_3}=40,74\end{cases}}\)
\(\rightarrow n_{Al}=0,18mol\)
\(\rightarrow n_{NH_4NO_3}=0,03mol\)
\(\rightarrow m=m_{Al}=4,86g\)