cho 10 lít khí H2 tác dụng với 6,72 lít Cl2 (đktc). Tính khối lượng HCl thu được, biết hiệu suất phản ứng là 60% và mất mát là 5%.Xin cảm ơn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Em kiểm tra lại đề nhé. Dữ kiện mất mát 5% hơi mẫu thuẫn. Vì hiệu suất có là 60% nên lượng mất mát đã là 40% rồi

PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Al\left(LT\right)}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\n_{HCl\left(LT\right)}=2n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\)
Mà: H% = 80%
\(\Rightarrow\left\{{}\begin{matrix}n_{Al\left(TT\right)}=\dfrac{0,2}{80\%}=0,25\left(mol\right)\\n_{HCl\left(TT\right)}=\dfrac{0,6}{80\%}=0,75\left(mol\right)\end{matrix}\right.\)
⇒ mAl = 0,25.27 = 6,75 (g)
mHCl = 0,75.36,5 = 27,375 (g)

\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)

\(PTHH: H_2 + Cl_2 ---> 2HCl \)
\(nH2 = \dfrac{10}{22,4}=\dfrac{25}{56} (mol)\)
\(nCl2 = \dfrac{6,72}{22,4} = 0,3(mol)\)
So sánh: \(\dfrac{nH2}{1} > \dfrac{nCl2}{1}\)
=> Chọn \(nCl2 \) để tính
Theo PTHH: \(nHCl = 2.nCl = 2.0,3 = 0,6(mol)\)
\(=> mHCl \)(lí thuyết) \( = 0,6.36,5 = 21,9 (mol)\)
Vì H = 60%
\(=> mHCl \)thực tế = \(\dfrac{21,9.60}{100} = 13,14 (g)\)
Vì mất mát 5%
=> mHCl = 13,14 - \(\frac{13,14.5}{100}\) = 12,483 (g)

\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

$N_2 + 3H_2 \buildrel{{t^o,xt,p}}\over\rightleftharpoons 2NH_3$
Ta thấy : $V_{N_2} : 1 > V_{H_2} : 3$ nên $N_2$ dư
Gọi hiệu suất là a
Suy ra : $V_{H_2\ pư} = 11,2a(lít)$
$V_{N_2\ pư} = \dfrac{11,2a}{3}$
$V_{NH_3} = \dfrac{2.11,2a}{3} $
Ta có :
$11,2 - 11,2a + 6,72 - \dfrac{11,2a}{3} + \dfrac{2.11,2a}{3} = 13,44$
$\Rightarrow a = 0,6 =6 0\%$
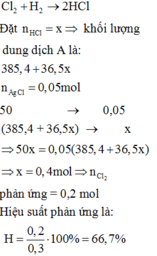
\(H_2+Cl_2\left(0,18\right)\rightarrow2HCl\left(0,36\right)\)
\(n_{H_2}=\frac{10}{22,4}\approx0,446\left(mol\right)\)
\(n_{Cl_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
Vì \(\frac{n_{H_2}}{1}=0,446>\frac{n_{Cl_2}}{1}=0,3\) nên ta tính HCl theo Cl2
Số mol Cl2 tham gia phản ứng là: \(0,3.60\%=0,18\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,36.36,5=13,14\left(g\right)\)
\(\Rightarrow m_{HCl\left(conlai\right)}=13,14.\left(100\%-5\%\right)=12,483\left(g\right)\)