Trộn hỗn hợp khí hidro và oxi theo tỉ lệ khối lượng 3/16 rồi nạp vào bình khí có dung tích thực 4,48l (đktc). Bật tia lửa điện để phản ứng hóa hợp xảy ra hoàn toàn. Tính khối lượng từng chất có trong bình sau phản ứng
Giúp mình với![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Từ dB/H2 = 19 tính được nO2 : nO3 = 5 : 3
Giả sử nA =3; nB = 6,4 → nO2 = 4; nO3 = 2,4; → nO = 4.2+2,4.3=15,2
Đặt CTC 3 hidrocacbon là CxHy
CxHy + (2x+y/2)O → xCO2 + y/2H2O
Ta có 2x/y = 2,6/2,4 và 2x + y/2 = 15,2/3 → x = 26/15; y = 3,2
MA = 12.26/15 + 3,2 = 24; dA/H2 =12

448 ml ở đktc là 0,02 mol.
Số mol ozon có trong oxi đã được ozon hoá : 0,03/16 = 0,001875 (mol) hay 0,09 (g).
Số mol oxi có trong bình : 0,02 - 0,001875 = 0,018125 (mol) hay 0,58 g.
Khối lượng của hỗn hợp : 0,09 + 0,58 = 0,67 (g).
Phẩn trăm khối lượng cua ozon trong hỗn hợp : 0,09 x 100/0,67 = 13,43%

Đáp án D
Phân tích: Nhìn vào đáp án thấy có 3 đáp án đều là amin no, 1 amin không no. Vì vậy trong giải nhanh ta hoàn toàn có quyền giả sử đó là amin no để tìm. Nếu không có trường hợp nào thỏa mãn thì amin không no ở đáp án C sẽ là chính xác.
Giả sử amin X có công thức: CnH2n+3N và giả sử có 1 mol X tham gia phản ứng (không mất tính tổng quát theo phưong pháp tự chọn lượng chất). Phưong trình cháy:
![]()
Khí thu được sau khi cho phản cháy đi qua NaOH đặc dư chứa:
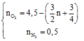
Mặt khác theo khối lượng mol trung bình của hỗn hợp khí. Sử dụng phương pháp đường chéo dễ dàng suy ra 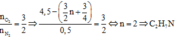

Đây là một ví dụ rất đơn giản nhưng đặc trưng về quan hệ số mol trong phản ứng cộng hidro của hidrocacbon chưa no
Dễ tính đươc
![]()
Trong phản ứng hidro hóa hidrocacbon chưa no thì số mol khí giảm chính bằng số mol hidro phản ứng suy ra ![]()
Mặt khác đề cho hidrocacbon dư, phản ứng hoàn toàn nên
![]()
suy ra ![]()

Gọi số mol H2, O2 là a, b (mol)
=> \(\left\{{}\begin{matrix}a+b=\dfrac{22,4}{22,4}=1\\M_B=\dfrac{2a+32b}{a+b}=5,5.2=11\left(g/mol\right)\end{matrix}\right.\)
=> a = 0,7 (mol); b = 0,3 (mol)
PTHH: 2H2 + O2 --to--> 2H2O
Xét tỉ lệ: \(\dfrac{0,7}{2}>\dfrac{0,3}{1}\) => H2 dư, O2 hết
PTHH: 2H2 + O2 --to--> 2H2O
0,6<--0,3------->0,6
=> \(\left\{{}\begin{matrix}m_{H_2O}=0,6.18=10,8\left(g\right)\\m_{H_2\left(dư\right)}=\left(0,7-0,6\right).2=0,2\left(g\right)\end{matrix}\right.\)
Gọi số mol của H2 trong hỗn hợp, O2 trong hỗn hợp và H2 tham gia phản ứng lần lược là x, y
Ta có: \(\frac{2x}{32y}=\frac{3}{16}\)
\(\Leftrightarrow3y=x\left(1\right)\)
\(2H_2\left(2y\right)+O_2\left(y\right)\rightarrow2H_2O\left(2y\right)\)
Ta có: \(\frac{x}{2}=\frac{3y}{2}>\frac{y}{1}\) nên O2 phản ứng hết
Ta có số mol hỗn hợp sau phản ứng gồn H2 dứ với hơi nước
\(n_{H_2}=3y-2y=y\)
\(\Rightarrow y+2y=\frac{4,48}{22,4}=0,2\)
\(\Rightarrow y=\frac{1}{15}\)
\(\Rightarrow m_{H_2}=\frac{1}{15}.2=\frac{2}{15}\)
\(\Rightarrow m_{H_2O}=\frac{2}{15}.18=2,4\)