hòa tan hoàn toàn một kim loại kiềm thổ R vào 200ml dung dịch HCl 2M.Để trung hòa lượng axit dư cần 100ml dung dịch NaOH 3M xác định tên kim loại đó.....trân thành cẳm ơn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH} =0,2.0,1 = 0,02(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,01(mol)\\ \Rightarrow n_{H_2SO_4\ pư} = 0,1.0,3 - 0,01 = 0,02(mol)\)
Gọi n là hóa trị của kim loại R
\(2R + nH_2SO_4\to R_2(SO_4)_3 + nH_2\\ n_R = \dfrac{2}{n}n_{H_2SO_4} = \dfrac{0,04}{n}(mol)\\ \Rightarrow \dfrac{0,04}{n}.R = 1,3\\ \Rightarrow R = \dfrac{65}{2}n\)
Với n = 2 thì R = 65(Zn)

Bài 1:
Gọi KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
Theo PT: \(n_A=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: KL cần tìm là Mg.
Bài 2:
PT: \(2R+6HCl\rightarrow2RCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{9,408}{22,4}=0,42\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{3}n_{H_2}=0,28\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,56}{0,28}=27\left(g/mol\right)\)
Vậy: R là Al.

1.
2M + 2xHCl -> 2MClx + xH2
nH2=0,03(mol)
Theo PTHH ta có:
nM=\(\dfrac{2}{x}\)nH2=\(\dfrac{0,06}{x}\)
MM=0,72:\(\dfrac{0,06}{x}=12x\)
Ta thấy với x=2 thì M=24 (t/m)
Vậy M là magie,KHHH là Mg
2.
R + 2HCl -> RCl2 + H2 (1)
NaOH + HCl -> NaCl + H2O (2)
nHCl=0,2.2=0,4(mol)
nNaOH=0,3(mol)
Theo PTHH 2 ta có:
nNaOH=nHCl(2)=0,3(mol)
nHCl(1)=0,4-0,3=0,1(mol)
Theo PTHH 1 ta có:
\(\dfrac{1}{2}\)nHCl=nR=0,05(mol)
MR=\(\dfrac{6,85}{0,05}=137\)
Vậy R là bari,KHHH là Ba
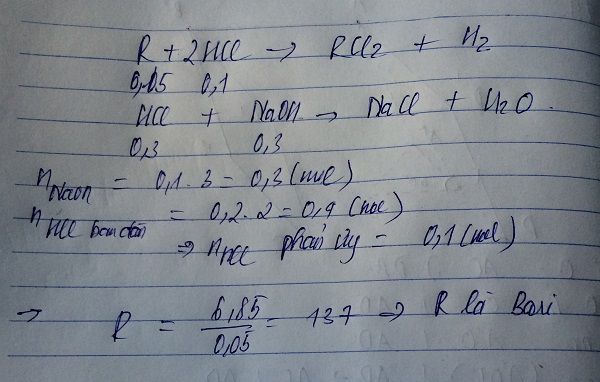

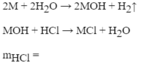
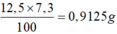


Đề thiếu m
NaOH + HCl = NaCl + H2O
0,3 - - - - 0,3
=>số mol HCl pư là 0,1 mol
=>số mol OH- = số mol H+ = số mol HCl = 0,1 mol
=>số mol kiềm thổ là 0,05 mol
=>R = 6,85 / 0,05 = 137 => Ba