Có 32g hỗn hợp gồm CuO và Fe2O3, biết số mol của CuO gấp đôi số mol Fe2O3. Tìm số mol mỗi chất trong hỗn hợp.
Đang cần gấp.. mọi người giúp mình nha!! Thanks you!! ^^![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi \(n_{Fe_2O_3}=a\left(mol\right)\Rightarrow n_{CuO}=3a\left(mol\right)\)
Ta có: \(m_{hh}=160a+80.3a=400a\left(g\right)\)
\(\%m_{Fe_2O_3}=\dfrac{160a.100\%}{400a}=40\%\)
\(\%m_{CuO}=100-40=60\%\)

\(n_{CuO}=2a\left(mol\right)\Rightarrow n_{Fe_2O_3}=a\left(mol\right)\)
\(m_X=80\cdot2a+160a=80\left(g\right)\)
\(\Rightarrow a=0.25\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(n_{H_2}=0.5+0.25\cdot3=1.25\left(mol\right)\)
\(V_{H_2}=1.25\cdot22.4=28\left(l\right)\)
\(m_{cr}=0.5\cdot64+0.5\cdot56=60\left(g\right)\)

a) Gọi số mol H2 là x
=> nH2O=x(mol)
Theo ĐLBTKL: mA+mH2=mB+mH2O
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> VH2=2,75.22,4=61,6(l)
b) Gọi nCuO=a(mol)
nFe2O3=1,5a(mol)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{15}\)
%mCuO=\(\dfrac{0,5.80}{200}\).100%=20%
%mFe2O3=\(\dfrac{0,75.160}{200}\).100%=60%
%mAl2O3=\(\dfrac{\dfrac{20}{15}102}{200}\).100%=20%
c) nH2=\(\dfrac{2,75}{5}\)=0,55(mol)
nFeO(tt)=\(\dfrac{36}{72}\)=0,5(mol)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> H%=\(\dfrac{0,4}{0,5}\).100%=80%

Đặt nFe2O3 = x (mol) ⇒ nCuO = \(\dfrac{1}{2}\)x
1. PTHH:
CuO + H2SO4 → CuSO4 + H2O (1)
1 mol : 1mol : 1 mol : 1 mol
\(\dfrac{1}{2}\)x : \(\dfrac{1}{2}\)x : \(\dfrac{1}{2}\)x : \(\dfrac{1}{2}\)x
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (2)
1 mol : 3 mol : 1 mol : 3 mol
x mol : x mol : x mol : x mol
nH2SO4 = \(\dfrac{68,6}{98}\)= 0,7 (mol)
Theo (1) và (2): nH2SO4 = \(\dfrac{1}{2}\)x + 3x = 0,7 ⇒ x = 0,2 (mol)
⇒ nCuO = \(\dfrac{1}{2}\)x = \(\dfrac{1}{2}\).0,2 = 0,1 (mol)
2. mCuO = n.M = 0,1.80 = 8 (g)
mFe2O3 = n.M = 0,2.160 = 32 (g)
mhh A = mCuO + mFe2O3 = 8 + 32 = 40 (g)
% khối lượng mỗi oxit trong hỗn hợp A lần lượt là:
%mCuO = \(\dfrac{m_{CuO}}{m_{hhA}}\).100% = \(\dfrac{8}{40}\).100% = 20%
%mFe2O3 = 100% - 20% = 80%

Gọi \(\left\{{}\begin{matrix}n_{Fe_2O_3}=a\left(mol\right)\\n_{Al_2O_3}=2a\left(mol\right)\\n_{CuO}=3a\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
a ---------> 3a
CuO + H2 --to--> Cu + H2O
3a ------> 3a
\(\rightarrow3a+3a=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ \Leftrightarrow a=0,1\left(mol\right)\\ \rightarrow m=0,1.160+0,1.2.102+0,1.3.80=60,4\left(g\right)\)
Gọi \(n_{Fe_2O_3}=x\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al_2O_3}=2x\left(mol\right)\\n_{CuO}=3x\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
3x 3x
\(Al_2O_3+3H_2\rightarrow2Al+3H_2O\)
2x 6x
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
x 3x
\(\Rightarrow\Sigma n_{H_2}=3x+6x+3x=0,6\Rightarrow x=0,05mol\)
\(\Rightarrow m=m_{CuO}+m_{Al_2O_3}+m_{Fe_2O_3}\)
\(\Rightarrow m=3\cdot0,05\cdot80+2\cdot0,05\cdot102+0,05\cdot160=30,2g\)

\(n_{CuO}=4a\left(mol\right)\Rightarrow n_{FeO}=a\left(mol\right)\)
\(m_X=80\cdot4a+72a=19.6\left(g\right)\)
\(\Rightarrow a=0.05\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(FeO+H_2\underrightarrow{^{^{t^0}}}Fe+H_2O\)
\(m_{cr}=0.2\cdot64+0.05\cdot56=15.6\left(g\right)\)
\(V_{H_2}=\left(0.05\cdot4+0.05\right)\cdot22.4=5.6\left(l\right)\)
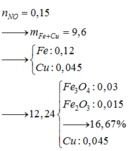
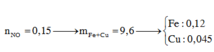
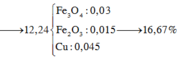
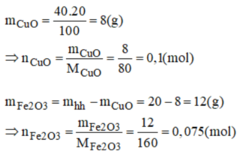

gọi nFe2O3=x => nCuO = 2x
ta có 160x + 80.2x = 32 => x=0,1 => 2x =0,2
=> nCuO= 0,2 nFe2O3 = 0,1