Cho 2,02 gam hỗn hợp Mg và Zn vào cốc(1)đựng 200ml đung dịch HCl.sau phản ứng cô cạn dung dich được 4,86 gam chất rắn.cho 2,02 gam hỗn hợp trên vào cốc(2) đựng 400ml dung dịch HCl như trên,sau phản ứng cô cạn dung dịch được 5,57 gam chất rắn.a)tính thể tích khí thoát ra ở cốc(1)(đktc)b)tính nồng độ mol/lit của dung dich HCl.c)tinh%khối lượng mỗi kim loại.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Khối lượng chất rắn tăng = mCl đi vào muối
Vì khi tăng HCl thì khối lượng chất rắn tăng => thí nghiệm đầu chắc chắn kim loại dư
=> 34,575 – 18,6 = 35,5.0,5x => x = 0,9
=> nCl muối sau = 0,6 mol < nHCl sau = 0,72 mol => HCl dư
=> nFe + nZn = ½ nCl muối = 0,3 mol và 56nFe + 65nZn = 18,6g
=> nFe = 0,1 => mFe = 5,6g
=>A

Xét TN1:
PTHH: Fe + 2HCl FeCl2 + H2 (1)
Giả sử: Fe phản ứng hết Chất rắn là FeCl2
*Xét TN2:
PTHH: Mg + 2HCl MgCl2 + H2 (2)
Fe + 2HCl FeCl2 + H2 (3)
Ta thấy: Ngoài a gam Fe như thí nghiệm 1 cộng với b gam Mg mà chỉ giải phóng: < 0,024 (mol)
Chứng tỏ: Trong TN1: Fe dư, HCl hết
Ta có: nHCl (TN 1) = nHCl(TN 2) = 2nH = 2 . 0,02 = 0,04(mol)
TN1:
nFe(pư) = nFeCl= nHCl = . 0,04 = 0,02(mol)
=> mFe(dư) = 3,1 – 0,02.127 = 0,56 (gam)
mFe(pư) = 0,02 . 56 = 1,12(gam)
=> mFe = a = 0,56 + 1,12 = 1,68(gam)
*TN2:
Áp dụng ĐLBTKL:
a + b = 3,34 + 0,02.2 - 0,04.36,5 = 1,92 (g)
Mà a = 1,68g b = 1,92 - 1,68 = 0,24 (g)

Gọi $n_{HCl} = x(mol) ; n_{Fe} = y(mol) ; n_{Mg} = z(mol)$
Thí nghiệm 1 : HCl hết, Fe dư
Fe + 2HCl → FeCl2 + H2
0,5x....x.............0,5x......................(mol)
Ta có :
127.0,5x + (y - 0,5x).56 = 6,91(1)
Thí nghiệm 2 : Mg,HCl hết, Fe dư
Mg + 2HCl → MgCl2 + H2
z.........2z.............z.........z..........(mol)
Fe + 2HCl → FeCl2 + H2
0,5(x - 2z).....(x-2z)...........0,5(x-2z)....0,5(x-2z)......(mol)
Ta có :
$n_{H_2} = z + 0,5(x -2z) = 0,05(2)$
95z + 0,5(x -2z).127 + [y-0,5(x - 2z)].56 = 7,63(3)$
Từ (1)(2)(3) suy ra x = 0,1 ; y = 0,06 ; z = 0,03
Vậy :
a = 0,06.56 = 3,36 gam
b = 0,03.65 = 1,95 gam

- Pư xong, trong 2 cốc chỉ thu được dd trong suốt
→ CaCO3 và 2 kim loại A, B tan hết.
Ta có: nCaCO3 = 0,1 (mol) = nCO2
⇒ m cốc 1 tăng = mCaCO3 - mCO2 = 10 - 0,1.44 = 5,6 (g)
Mà: Sau pư khối lượng 2 cốc bằng nhau.
⇒ m cốc 2 tăng = 5,6 (g) = 5,8 - mH2
⇒ mH2 = 0,2 (g) ⇒ nH2 = 0,1 (mol)
Vì: A và B đều thuộc nhóm IA → gọi chung là X.
PT: \(2\overline{X}+2H_2O\rightarrow2\overline{X}OH+H_2\)
Theo PT: \(n_{\overline{X}}=2n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_{\overline{X}}=\dfrac{5,8}{0,2}=29\left(g/mol\right)\)
Mà: A và B nằm ở 2 chu kỳ liên tiếp.
⇒ A và B là: Na và K.

Chọn đáp án A
![]()
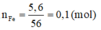
Bảo toàn electron:
2nCu + nFe2+ = 3nNO
=> nNO = (2.0,1 + 0,1 )/3 = 0,1 (mol)
BTNT N => nNaNO3= 0,1.85 = 8,5 (g)

NaNO3 + NH4HSO4 → Không xảy ra phản ứng
NaNO3 + Cu → Không xảy ra phản ứng
NH4HSO4 + Cu → Không xảy ra phản ứng
2NaNO3 + 8NH4HSO4 + 3Cu → 3CuSO4 + Na2SO4 + 4(NH4)2SO4 + 2NO + 4H2O
→ Đáp án B

Chọn đáp án A
![]()
Bảo toàn electron:
2nCu + nFe2+ = 3nNO
=> nNO = (2.0,1 + 0,1 )/3 = 0,1 (mol)
BTNT N => nNaNO3= 0,1.85 = 8,5 (g)

Ta biết, khối lượng muoi tang do tang axit (khoi luong kim loai ko tang) => khoi muoi tang la khoi luong tang từ HCl, trong đó Cl2 thêm vào muoi, H2 thoát ra
a, Áp dụng bảo toàn nguyên tố và bao toan khoi luong ta co: m(Cl) = m(Muoi) - m(Kim loai)= 4,86 - 2,02= 2,84
=====> n(H2) = 1/2n(HCl) = 1/2n(Cl) = 1/2 * 2,84/35,5= 0,04 (m0l)
====> V(H2) = 0,04 * 22,4 = 0,896 (L)
b,=====> m(Cl2) = m(muối tăng) = 5,57 - 4,86 = 0,71 (g)
===> n(HCl chênh lệch) = 2n(Cl2) = 2*0,71/71= 0,02
V(axit chênh lệch) = 0,4 - 0,2 = 0,2 (l)
=====> [HCl]= 0,02/ 0,2 =0,10