một dung dịch có pH=9,0 . Tính nồng độ mol của các ion H+ và OH- trong dung dịch . hãy cho biết màu của phenolphtalein trong dung dịch này .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


pH = 9,0 ≥ [H+] = 10-9 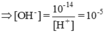
Cho phenolphtalein trong dung dịch này sẽ thấy phenolphtalein chuyển thành màu hồng (khi pH ≥ 8,3 phenolphtalein đổi màu)

pH=9 => CH+=10-9 và COH-=10-5
Đọo pH của dung dịch có môi trường kiêm nên Phenolphtalein có màu hồng (cái này trong sách giáo khoa 11 có)

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
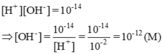
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

\(n_{Ba\left(OH\right)_2}=0,3.0,1=0,03\left(mol\right)\\ n_{HCl}=0,2.0,15=0,03\left(mol\right)\\ Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\\ Vì:\dfrac{n_{Ba\left(OH\right)_2\left(đề\right)}}{n_{Ba\left(OH\right)_2\left(PTHH\right)}}=\dfrac{0,03}{1}>\dfrac{n_{HCl\left(đề\right)}}{n_{HCl\left(PTHH\right)}}=\dfrac{0,03}{2}\\ \Rightarrow Ba\left(OH\right)_2dư\\ n_{Ba\left(OH\right)_2\left(p.ứ\right)}=\dfrac{n_{HCl}}{2}=\dfrac{0,03}{2}=0,015\\ n_{Ba\left(OH\right)_2\left(dư\right)}=0,03-0,015=0,015\left(mol\right)\\ \left[OH^-\right]=2.\left[Ba\left(OH\right)_2\left(dư\right)\right]=\dfrac{0,015}{0,3+0,2}=0,03\left(M\right)\\ \Rightarrow pH=14+log\left[OH^-\right]=14+log\left[0,03\right]\approx12,477\)
Nồng độ mol/lít các ion trong dd A:
\(\left[OH^-\left(dư\right)\right]=0,06\left(M\right)\left(nt\right)\\\left[Cl^-\right]=2.\left[BaCl_2\right]=2.\left(\dfrac{0,015}{0,5}\right)=0,06\left(M\right)\\ \left[Ba^{2+}\right]=0,03+ 0,03=0,06\left(M\right)\)

\(\left[OH^-\right]=0,001M\\ \Rightarrow pH=14-pOH=14+log\left[OH^-\right]=14+log\left[0,001\right]=14-3=11\)
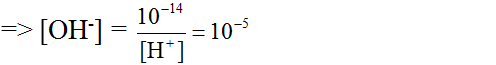

[OH-] = 10^-14 : [H+] = 10^-12
pH = -log[H+] = 2 <7 => mt axit
pH = 9 => [H+] = 10^-9 => [OH-] = 10^-5 => mt bazo, phenolphtalein chuyển hồng