Cho 0,1 mol axit HCl vào 200 ml dung dịch NaOH aM. Xác định a biết rằng dung dịch sau phản ứng hòa tan được 3,9 gam Al(OH)3.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Coi hh X gồm H 2 N C 3 H 5 C O O H 2 và HCl không phản ứng với nhau và đều phản ứng với NaOH
→ n N a O H p h ả n ứ n g = n g ố c C O O H + n H C l = 0 , 1 . 2 + 0 , 3 = 0 , 5 m o l
Đáp án cần chọn là: A

Đáp án D
Số mol HCl dư =0,1 (mol)
Số mol kết tủa
![]()
Số mol ![]()
Số mol HCl ban đầu = 3 . 0 , 1 + 0 , 1 = 0 , 4 ⇒ a = 2

Đáp án A
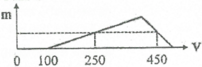
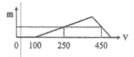
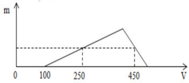
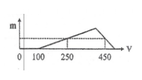
X gồm HCl dư (x mol) và AlCl3 (y mol)
=> x = 0,1 mol
+ Tại nNaOH = 0,25 mol: nNaOH = nHCl + 3nAl(OH)3 => nAl(OH)3 = (0,25-0,1)/3 = 0,05 mol
+ Tại nNaOH = 0,45 mol: nNaOH = nHCl + 4nAl3+ - nAl(OH)3 => 0,45 = 0,1 + 4y – 0,05 => y = 0,1 mol
BT “Cl” => nHCl = 3nAlCl3 + nHCl dư => nHCl = 0,1 + 3.0,1 = 0,4 mol
=> a = 0,4/0,2 = 2M

Đáp án A
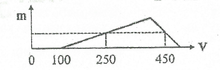
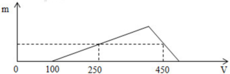
X gồm HCl dư (x mol) và AlCl3 (y mol)
=> x = 0,1 mol
+ Tại nNaOH = 0,25 mol: nNaOH = nHCl + 3nAl(OH)3 => nAl(OH)3 = (0,25-0,1)/3 = 0,05 mol
+ Tại nNaOH = 0,45 mol: nNaOH = nHCl + 4nAl3+ - nAl(OH)3 => 0,45 = 0,1 + 4y – 0,05 => y = 0,1 mol
BT “Cl” => nHCl = 3nAlCl3 + nHCl dư => nHCl = 0,1 + 3.0,1 = 0,4 mol
=> a = 0,4/0,2 = 2M


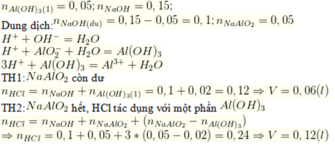
$n_{Al(OH)_3} = 0,05(mo)$
$NaOH + HCl \to NaCl + H_2O$
TH1 : Axit dư
$3HCl + Al(OH)_3 \to AlCl_3 + 3H_2O$
Theo PTHH :
$n_{HCl} = 0,2a + 0,05.3 = 0,1 \Rightarrow a = -0,25 <0 \to$ Loại
TH2 : NaOH dư
$NaOH + Al(OH)_3 \to NaAlO_2 + 2H_2O$
Ta có :
$n_{NaOH} = 0,1 + 0,05 =0,15(mol) \Rightarrow a = \dfrac{0,15}{0,2} = 0,3M$