Hòa tan m gam d2 ZnSO4 vào nước được d2 B. Tiến hành 2 thí nghiệm sau: tn1: cho dung dịch B tác dụng 110ml dung dịch KOH 2M thu đk 3a kết tủa. tn2:cho dung dịch B tác dụng với 140 ml dd KOH 2M thu đk 2a g kết tủa. Tìm m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Đặt 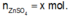
n Zn OH 2 TN 1 n Zn OH 2 TN 2 = m Zn OH 2 TN 1 m Zn OH 2 TN 2 = 3 a 2 a = 3 2 ⇒ n Zn OH 2 TN 1 = 3 y , n Zn OH 2 TN 2 = 2 y
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 Zn OH 2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
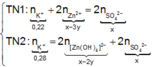
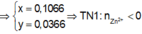 loại
loại
● Nếu ở TN1 Zn OH 2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
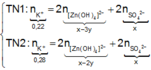
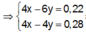
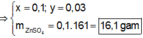

Đáp án B
Đặt
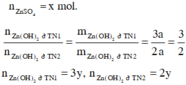
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
Nếu ở TN1 Zn(OH)2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :

Từ (*) suy ra : TN1 đã có hiện tượng hòa tan kết tủa : Không thỏa mãn.
Vậy ở TN1 Zn(OH)2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
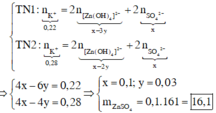

Đáp án : C
Giả sử cả 2 trường hợp đều có hiện tượng hòa tan kết tủa
Xét công thức tính nhanh chung : nOH = 4nZn2+ - 2nZn(OH)2
+) TN1 : 0,22 = 4nZn2+ - 2.3a/99
+) TN2 : 0,28 = 4nZn2+ - 2.2a/99
=> nZn2+ = 0,1 mol => m = 16,1g

Đáp án B
Chọn số mol mỗi chất là 1 mol
A. Loại vì m 1 < m 2 < m 3
m 1 = + = 1.100 + 1.90 = 190 (g)
m 2 = + = 1.100 + 1.116 = 216 (g)
m 3 = mAgCl + mAg = 2.143,5 + 1.108 = 395 (g)
B. Chọn vì m 1 < m 3 < m 2
m 1 = = 90 (g) ; m 2 = = 116 (g) ; m 3 = mAg = 108 (g)
C. Loại vì m 3 > m 2 > m 1
m 1 = = 90 (g); m 2 = = 116 (g) ; m 3 = mAgCl + mAg = 3.143,5 + 1.108 = 538,5 (g)
D. Loại vì m 1 = m 2 > m 3
m 1 = = 197 (g); m 2 = = 197 (g); m 3 = mAgCl = 143,5 (g)

Đáp án A
Vì hai thí nghiệm đều thu được cùng một lượng kết tủa và lượng KOH dùng ở thí nghiệm 2 lớn hơn lượng KOH dùng ở thí nghiệm 1 nên ở thí nghiệm 1 chưa có sự hòa tan kết tủa và ở thí nghiệm 2, sau khi lượng kết tủa đạt giá trị cực đại đã bị hòa tan một phần.
Áp dụng công thức cho hai trường hợp cùng thu được một lượng kết tủa ta có hệ phương trình


Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
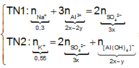
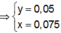
![]() thỏa mãn
thỏa mãn
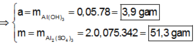
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
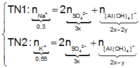
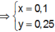
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.

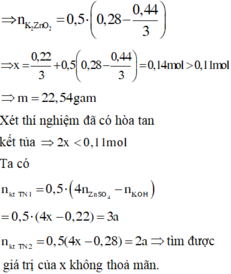

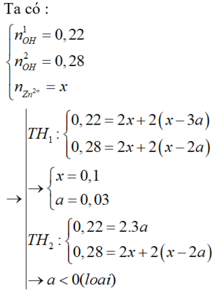
TN1. nKOH = 0,22 mol
2KOH + ZnSO4 → Zn(OH)2 + K2SO4 (1)
2KOH + Zn(OH)2 → K2ZnO2 + 2H2O (2)
Gọi x là số mol của Zn(OH)2 phản ứng ở pt (2)
ð Số mol của Zn(OH)2 tạo ra ở pt (1) là \(x+\frac{3a}{99}\); nKOH = 2x + \(2\left(x+\frac{3a}{99}\right)\)= 0,22 mol (1')
TN2. nKOH = 0,28 ; Lượng KOH ở thí nghiệm 2 lớn hơn TN1 là 0,28 – 0,22 = 0,06 mol.
Tương tự như trên ta có: nKOH = (2x + 0,06) + \(2\left(x+0,03+\frac{2a}{99}\right)\)= 0,28 mol (2')
Từ (1') và (2') => x = 0,01 ; a = 2,97 ==> nZnSO4 = = 0,1 mol => mZnSO4 = 161.0,1 = 16,1g
bài này có 3 cách giải hẵn hoi nhé