Tính khối lượng FES2 cần dùng để sản xuất 200kg axit H2SO4 . Biết hiệu suất của cả quá trình là 80% .(xin mọi người đừng giải bảo toàn nguyên tố vì mình chưa học)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C.
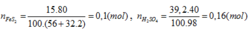
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Từ 120kg FeS2 có thể sản xuất đc bao nhiêu kg axit H2SO4 98%? Biết hiệu suất của cả quá trình là 80%

$n_{FeS_2} = \dfrac{120}{120} = 1(kmol)$
$n_{FeS_2\ pư} = 1.80\% = 0,8(kmol)$
Bảo toàn nguyên tố với S :
$n_{H_2SO_4} = 2n_{FeS_2\ pư} = 1,6(kmol)$
$m_{dd\ H_2SO_4} = \dfrac{1,6.98}{98\%} = 160(kg)$

\(m_{H_2SO_4}=10^6\cdot98\%=980000\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{980000}{98}=10000\left(mol\right)\)
Bảo toàn nguyên số S :
\(2n_{FeS_2}=n_{H_2SO_4}\Rightarrow n_{FeS_2}=\dfrac{10000}{2}=5000\left(mol\right)\)
\(\Rightarrow n_{FeS_2\left(tt\right)}=\dfrac{5000}{80\%}=6250\left(g\right)\)
\(m_{FeS_2}=6250\cdot120=750000\left(g\right)=0.75\left(tấn\right)\)
\(m_{quặng}=\dfrac{0.75}{75\%}=1\left(tấn\right)\)

\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)

Đáp án C
FeS2 → Fe → thép không gỉ.
Khối lượng quặng thực tế: 12 . 0 , 74 . 120 56 . 0 , 6 . 0 , 8 = 3 , 7 ( tấn )

Ta có sơ đồ
FeS2--->2H2SO4
120g 2.98g
6000/49kg 200kg
Vì hiệu suất 80% nên mFeS2=6000/49 .100/80=153,06kg