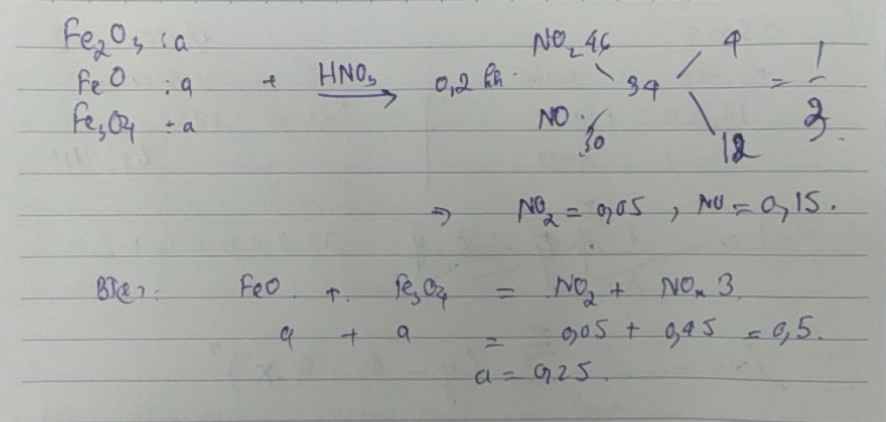Cho 9.12g hh gồm FeO; Fe2O3; Fe3O4; t/d vs dd HCl dư. Sau phản ứng sảy ra hoàn toàn thu đk dd Y. cô cạn Y thu đk 7.62g FeCl2 và m gam dd FeCl3 . hãy xác định m . Ai giúp mình vs nha !!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


-Cho vào dd H2SO4(l) dư
+)Nếu có khí thoát ra:Fe
Fe+H2SO4⇒FeDO4+H2
+)Các khí còn lại 0 hiện tượng
-Cho các khí còn lại vào dd NaOH dư:
+)Mẫu xuất hiện kết tủa nâu đỏ:Fe2O3
+)Mẫu xuất hiện kết tủa trắng xanh và hóa nâu đỏ trong không khí:Fe
+)Mẫu vừa xuất hiện kết tủa trắng xanh vừa xuất hiện kết tủa nâu đỏ và hóa nâu đỏ trong không khí:Fe3O4

1
\(n_O=\dfrac{16-11,2}{16}=0,3\left(mol\right)\)
=> \(n_{H_2O}=0,3\left(mol\right)\)
=> \(n_{H_2}=0,3\left(mol\right)\)
=> \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
2
\(n_{HCl}=0,4.1=0,4\left(mol\right)\)
PTHH: X + 2HCl --> XCl2 + H2
0,2<--0,4
=> \(M_X=\dfrac{13}{0,2}=65\left(g/mol\right)\)
=> X là Zn

\(n_{Fe_2O_3}=n_{FeO}=n_{Fe_3O_4}=a\\ n_{NO_2}:n_{NO}=\dfrac{46-34}{34-30}=3\\ n_{NO_2}+n_{NO}=\dfrac{4,48}{22,4}=0,2\\ n_{NO_2}=0,15;n_{NO}=0,05\\ BTe:a+a=0,15+0,15\\ a=0,15\\ m_A=a\left(160+232+72\right)=69,6g\\ BT\left[N\right]:V_{HNO_3}=\dfrac{6a\cdot3-0,2}{2}=1,25L\)

Giả sử hh hết
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (1)
0,1 \(\rightarrow\) 0,2 (mol)
Fe2O3 + 6HCl \(\rightarrow\) 2FeCl3 + 3H2O (2)
0,1 \(\rightarrow\) 0,6 (mol)
nHCl pư = 0,8 > 0,4 (mol)
=> Giả sử sai
=|>HCl hết
Gọi số mol MgO , Fe2O3 pư lần lượt là x , y
Theo pt (1),(2) nHCl = 2x + 6y = 0,4 (mol) (l)
Tỉ lệ số mol của MgO : Fe2O3 ban đầu là tỉ lệ MgO : Fe2O3 pư
=> \(\frac{x}{y}\) = \(\frac{0,1}{0,1}\) = 1 (ll)
Giải hệ pt (l) ,(ll)=> x=y=0,05
=|> Mmuối = 0,05 . 95 + 0,05 . 2 . 162,5 = 21 (g)