cho 5,9 gam hỗn hợp X gồm Cu và Al tác dụng với H2SO4 đặc , nguội dư thì khí SO2 thoát ra đủ làm mất màu 50 ml dung dịch Br2 1M . Tổng số mol của hỗn hợp 2 kim loại trên là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%

\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)


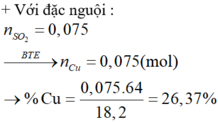

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol